Descrieți structura electronică a benzenului. Structura benzenului
Punctul de vedere modern asupra structurii benzenului: o moleculă plată, ai cărei atomi de carbon sunt într-o stare de hibridizare sp 2 și sunt combinați într-un hexagon obișnuit.

Imaginea unei molecule de benzen:
![]()
Aromaticitate- energia neobișnuit de scăzută a stării neexcitate cauzată de delocalizarea electronilor π.
Aromaticitate-un concept care caracterizează totalitatea proprietăților structurale, energetice și caracteristicile de reactivitate ale structurilor ciclice cu un sistem de legături conjugate
Semne de aromaticitate Orice compus este aromatic dacă are: a) un inel plat închis; b) un sistem de electroni π conjugați, care acoperă toți atomii ciclului; c) dacă numărul de electroni implicați în conjugare corespunde formulei Hückel (4n+2., unde n este numărul de cicluri).
Izomerie

Nomenclatură

orto-, meta-Şi pereche-înlocuit:


Proprietăți fizice
Toți compușii aromatici au un miros. Benzen, toluen, xilen, etilbenzen,
cumen, stiren - lichide, naftalina, antracen - solide.
26. Hidrocarburi aromatice din seria benzenului. Nomenclatură. Izomerie. Metode de obținere a benzenului și a omologilor săi: din gudron de cărbune, aromatizarea și dehidrociclizarea parafinelor, după reacția Wurtz-Fittig, alchilare Friedel-Crafts cu olefine, halogenuri de alchil, alcooli, din sărurile acidului benzoic, trimerizarea alchinelor.
Arenele (hidrocarburile aromatice) sunt compuși ciclici ale căror molecule conțin unul sau mai mulți nuclei de benzen. Formula empirică a benzenului C6H6
Izomerie
Hidrocarburile aromatice di-, tri- și tetra-substituite sunt caracterizate prin izomeria poziției substituentului și izomeria catenei alchil laterale.

Arenele mono-, penta- și hexa-substituite nu au izomeri asociați cu poziția substituentului în inel.
Nomenclatură
Derivații benzenului se numesc benzeni substituiți. Pentru multe dintre ele, fie sunt folosite nume banale, fie substituentul este indicat printr-un prefix înaintea cuvântului „benzen”. În cazul benzenilor monosubstituiți, denumirile nu includ numere, deoarece toți cei șase atomi de carbon ai moleculei de benzen sunt echivalenți și este posibil doar un benzen monosubstituit pentru fiecare substituent.

Dacă pe o moleculă de benzen sunt prezenți doi substituenți, atunci pot exista trei benzeni disubstituiți diferiți. Ele sunt denumite în consecință orto-, meta-Şi pereche-înlocuit:

Dacă benzenul are trei sau mai mulți substituenți, atunci poziția lor în inel ar trebui să fie indicată numai prin cifre. În toate cazurile, numele substituenților sunt enumerate înainte de cuvântul „benzen” în ordine alfabetică. Numărul 1 din nume poate fi omis substituentul de la care începe numărătoarea inversă este inclus în acest caz în baza numelui:

Chitanță:
1. Prelucrarea gudronului de cărbune, distilarea uleiului, distilarea uscată
lemn
2. Aromatizarea uleiului.

3. Dehidrociclizarea hexanului și heptanului.
C6H14 → C6H6 + 4H2
C7H16 → C6H5-CH3 + 4H2
4. Wurtz-Fittig:

Alchilarea Friedel-Crafts. Au fost acceptate două mecanisme de reacție posibile. În primul caz, particula electrofilă este un carbocation format ca urmare a interacțiunii unui haloalcan cu clorură de aluminiu (acid Lewis):
În al doilea caz, se poate presupune că electrofilul este gruparea alchil a complexului polar de AlCl3 cu o halogenură de alchil.
Alchilarea benzenului (reacția Friedel-Crafts)
C 6 H 6 + C 2 H 5 CI → C 6 H 5 -C 2 H 5 + HCI
27.Substitutie electrofila in seria aromatica (nitrare, sulfonare, halogenare, alchilare si acilare Friedel-Crafts). Conceptul de complexe - și . Mecanismul reacțiilor de substituție electrofile
Hidrocarburile aromatice formează o parte importantă a seriei ciclice de compuși organici. Cel mai simplu reprezentant al unor astfel de hidrocarburi este benzenul. Formula acestei substanțe nu numai că a distins-o de o serie de alte hidrocarburi, dar a dat și impuls dezvoltării unei noi direcții în chimia organică.
Descoperirea hidrocarburilor aromatice
Hidrocarburile aromatice au fost descoperite la începutul secolului al XIX-lea. În acele vremuri, cel mai comun combustibil pentru iluminatul stradal era gazul lampilor. Din condensatul său, marele fizician englez Michael Faraday a izolat trei grame de substanță uleioasă în 1825, i-a descris în detaliu proprietățile și a numit-o: hidrogen carburat. În 1834, omul de știință german, chimistul Mitscherlich, a încălzit acidul benzoic cu var și a obținut benzen. Formula pentru această reacție este prezentată mai jos:
Fuziunea C6 H5 COOH + CaO a C6 H6 + CaCO3.
La acea vreme, acidul benzoic rar se obținea din rășina acidului benzoic, care poate fi secretată de unele plante tropicale. În 1845, a fost descoperit un nou compus în gudronul de cărbune, care era o materie primă complet accesibilă pentru obținerea unei noi substanțe în scara industriala. O altă sursă de benzen este petrolul obținut din unele câmpuri. Pentru a satisface nevoile întreprinderilor industriale pentru benzen, acesta se obține și prin aromatizarea anumitor grupe de hidrocarburi aciclice ale uleiului.
Versiunea modernă a numelui a fost propusă de omul de știință german Liebig. Rădăcina cuvântului „benzen” ar trebui căutată în limbile arabe - acolo este tradusă ca „tămâie”.
Proprietățile fizice ale benzenului
Benzenul este un lichid incolor cu un miros specific. Această substanță fierbe la o temperatură de 80,1 o C, se întărește la 5,5 o C și se transformă într-o pulbere cristalină albă. Benzenul practic nu conduce căldura și electricitatea, este puțin solubil în apă și bine solubil în diferite uleiuri. Proprietățile aromatice ale benzenului reflectă esența structurii sale structura internă: inel benzenic relativ stabil și compoziție incertă.
Clasificarea chimică a benzenului
Benzenul și omologii săi - toluenul și etilbenzenul - sunt o serie aromatică de hidrocarburi ciclice. Structura fiecăreia dintre aceste substanțe conține o structură comună numită inel benzenic. Structura fiecăreia dintre substanțele de mai sus conține o grupare ciclică specială creată de șase atomi de carbon. Se numește inel aromatic benzen.
Istoria descoperirii
Stabilirea structurii interne a benzenului a durat câteva decenii. Principiile de bază ale structurii (modelul inelului) au fost propuse în 1865 de chimistul A. Kekule. După cum spune legenda, un om de știință german a văzut formula acestui element într-un vis. Mai târziu, a fost propusă o scriere simplificată a structurii unei substanțe numite benzen. Formula acestei substanțe este un hexagon. Simbolurile pentru carbon și hidrogen, care ar trebui să fie situate la colțurile hexagonului, sunt omise. Acest lucru produce un hexagon regulat simplu, cu linii simple și duble alternative pe laturi. Formula generală a benzenului este prezentată în figura de mai jos.

Hidrocarburi aromatice și benzen
Formula chimică a acestui element sugerează că reacțiile de adiție nu sunt tipice pentru benzen. Pentru aceasta, ca și pentru alte elemente din seria aromatică, sunt tipice reacțiile de substituție a atomilor de hidrogen din ciclul benzenic.
Reacția de sulfonare
Prin asigurarea interacțiunii dintre acid sulfuric concentrat și benzen, creșterea temperaturii de reacție, se poate obține acid benzosulfonic și apă. Formula structurală a benzenului în această reacție este următoarea:

Reacția de halogenare
Bromul sau cromul reacţionează cu benzenul în prezenţa unui catalizator. Aceasta produce derivați de halogen. Dar reacția de nitrare are loc folosind acid azotic concentrat. Rezultatul final al reacției este un compus azotat:

Folosind nitrarea, se produce un exploziv binecunoscut - TNT, sau trinitotoluen. Puțini oameni știu că tol se bazează pe benzen. Mulți alți compuși nitro pe bază de inel de benzen pot fi, de asemenea, utilizați ca explozivi
Formula electronică a benzenului
Formula standard a inelului benzen nu reflectă cu exactitate structura internă a benzenului. Potrivit acestuia, benzenul trebuie să aibă trei legături p localizate, fiecare dintre ele trebuie să interacționeze cu doi atomi de carbon. Dar, după cum arată experiența, benzenul nu are legături duble obișnuite. Formula moleculară a benzenului ne permite să vedem că toate legăturile din inelul benzenic sunt echivalente. Fiecare dintre ele are o lungime de aproximativ 0,140 nm, care este intermediară între lungimea unei legături simple standard (0,154 nm) și a unei legături duble de etilenă (0,134 nm). Formula structurală a benzenului, descrisă cu legături alternante, este imperfectă. Un model tridimensional mai plauzibil de benzen arată ca imaginea de mai jos.

Fiecare dintre atomii inelului benzenic este într-o stare de hibridizare sp 2. Cheltuiește trei electroni de valență pentru formarea legăturilor sigma. Acești electroni acoperă doi atomi de carbohidrați vecini și un atom de hidrogen. În acest caz, atât electronii, cât și legăturile C-C, H-H sunt în același plan.
Al patrulea electron de valență formează un nor în forma unui opt tridimensional, situat perpendicular pe planul inelului benzenic. Fiecare astfel de nor de electroni se suprapune deasupra planului inelului benzenic și direct sub acesta cu norii a doi atomi de carbon vecini.
Densitatea norilor n-electroni ai acestei substanțe este distribuită uniform între toate legăturile de carbon. În acest fel, se formează un singur nor de electroni inel. În chimia generală, o astfel de structură se numește sextet de electroni aromatici.
Echivalența legăturilor interne ale benzenului
Echivalența tuturor fețelor hexagonului explică egalizarea legăturilor aromatice, care determină substanța chimică caracteristică și proprietăți fizice, pe care o are benzenul. Formula pentru distribuția uniformă a norului de n-electroni și echivalența tuturor acestora conexiuni interne prezentat mai jos.

După cum puteți vedea, în loc să alternați linii simple și duble, structura internă este descrisă ca un cerc.
Esența structurii interne a benzenului oferă cheia înțelegerii structurii interne a hidrocarburilor ciclice și extinde posibilitățile de aplicare practică a acestor substanțe.
Compușii aromatici sunt cei ale căror molecule conțin un grup ciclic de atomi cu un model special de legătură - un inel benzenic. Nume internațional hidrocarburi aromatice – arene.
Cel mai simplu reprezentant al arenelor este benzenul C 6 H 6 . Formula care reflectă structura moleculei de benzen a fost propusă pentru prima dată de chimistul german Kekule (1865):
Atomii de carbon din molecula de benzen formează un hexagon plat obișnuit, deși este de obicei desenat ca unul alungit.
Structura moleculei de benzen a fost în cele din urmă confirmată de reacția de formare a acesteia din acetilenă. Formula structurală descrie trei legături simple și trei duble alternative carbon-carbon. Dar o astfel de imagine nu transmite adevărata structură a moleculei. În realitate, legăturile carbon-carbon din benzen sunt echivalente și au proprietăți care sunt diferite de cele ale legăturilor simple sau duble. Aceste caracteristici sunt explicate prin structura electronică a moleculei de benzen.
Structura electronică a benzenului.
Fiecare atom de carbon dintr-o moleculă de benzen este într-o stare de hibridizare sp 2. Este conectat la doi atomi de carbon vecini și un atom de hidrogen prin trei legături σ. Rezultatul este un hexagon plat: toți cei șase atomi de carbon și toți σ - Conexiuni S-Sși C-H se află în același plan. Norul de electroni al celui de-al patrulea electron (electronul p), care nu este implicat în hibridizare, are forma unei gantere și este orientat perpendicular pe planul inelului benzenic. Astfel de nori de electroni p de atomi de carbon vecini se suprapun deasupra și sub planul inelului  . Ca rezultat, șase electroni p formează un nor de electroni comun și unul singur legătură chimică pentru toți atomii de carbon. Două regiuni ale planului electronic mare sunt situate pe ambele părți ale planului de legătură σ
. Ca rezultat, șase electroni p formează un nor de electroni comun și unul singur legătură chimică pentru toți atomii de carbon. Două regiuni ale planului electronic mare sunt situate pe ambele părți ale planului de legătură σ 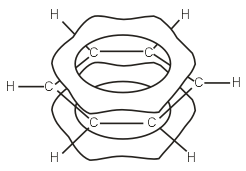 ./>/>
./>/>
p-Norul de electroni determină o reducere a distanței dintre atomii de carbon. Într-o moleculă de benzen, acestea sunt aceleași și egale cu 0,14 nm. În cazul unei legături simple și duble, aceste distanțe ar fi de 0,154 și, respectiv, 0,134 nm. Aceasta înseamnă că nu există legături simple sau duble în molecula de benzen. Molecula de benzen este un ciclu stabil cu șase atomi de grupări CH identice situate în același plan. Toate legăturile dintre atomii de carbon din benzen sunt echivalente, ceea ce determină proprietățile caracteristice ale inelului benzenic. Acest lucru este reflectat cel mai precis de formula structurală a benzenului sub forma unui hexagon regulat cu un cerc în interior ( eu ). (Cercul simbolizează echivalența legăturilor dintre atomii de carbon.) Cu toate acestea, formula lui Kekule este adesea folosită indicând legături duble ( II
Fișă pentru prelegerea 5





Cursul 5
HIDROCARBURI AROMATICE
CUVINTE CHEIE: hidrocarburi aromatice, arene, hibridizare sp2, nor de electroni p unic, conjugare circulară, mecanism ionic reacții de substituție, substituție electrofilă, nitrare, halogenare, alchilare Friedel-Crafts, alchilare cu alchene, hidrogenare, oxidare.
STRUCTURA MOLECULEI DE BEZEN. AROMATICITATE
Hidrocarburile aromatice (arenele) sunt hidrocarburi ale căror molecule conțin unul sau mai multe inele benzenice.
Cel mai simplu reprezentant al hidrocarburilor aromatice este benzenul, a cărui formulă moleculară este C 6 H 6. S-a stabilit că toți atomii de carbon dintr-o moleculă de benzen se află în același plan, formând un hexagon regulat (Fig. 1). Fiecare atom de carbon este legat de un atom de hidrogen. Lungimile tuturor legăturilor carbon-carbon sunt aceleași și se ridică la 0,139 nm.
Formulele a) și b) au fost propuse în 1865 de chimistul german August Kekule. În ciuda faptului că nu transmit cu exactitate structura moleculei de benzen, ele sunt încă folosite astăzi și sunt numite formule Kekulé.
Din punct de vedere istoric, denumirea de „hidrocarburi aromatice” a apărut deoarece mulți derivați de benzen, care au fost primii izolați din surse naturale, aveau un miros plăcut.
În prezent, conceptul de „aromaticitate” înseamnă, în primul rând, natura specială a reactivității substanțelor, care, la rândul său, este determinată de caracteristicile structurale ale moleculelor acestor compuși.
Care sunt aceste caracteristici?
În conformitate cu formula moleculară C6H6, benzenul este un compus nesaturat și se poate aștepta ca acesta să sufere reacții de adiție tipice alchenelor. Cu toate acestea, în condițiile în care alchenele suferă rapid reacții de adiție, benzenul nu reacționează sau reacționează lent. Benzen nu dă reacţii calitative caracteristice hidrocarburilor nesaturate: ea nu decolorează apa cu brom și soluție apoasă permanganat de potasiu.
Această natură a reactivității se explică prin prezența unui sistem conjugat în inelul aromatic - un singur p-nor de electroni.
Într-o moleculă de benzen, fiecare atom de carbon este în stare sp 2-hibridare si este inrudita prin trei s-legături cu doi atomi de carbon și un atom de hidrogen. Al patrulea electron de valență al atomului de carbon este situat pe p-orbital perpendicular pe planul moleculei. Suprapunerea laterală are loc în molecula de benzen r-orbitali ai fiecărui atom de carbon cu r-orbitali ai ambilor atomi de carbon vecini (Fig. 2). Ca urmare a acestei cuplari, a nor de electroni p unic, situat deasupra și sub planul inelului benzenic - se efectuează mate circular.
Un astfel de sistem ciclic cu un nor comun de șase electroni este foarte stabil și favorabil energetic; Prin urmare, benzenul intră de preferință în acele reacții în care inelul aromatic este reținut.
 O O |  b b |
Orez. 2. Structura electronică a moleculei de benzen: a) schema de suprapunere r-orbitali; b) un singur nor de electroni p.
Să subliniem încă o dată că într-o moleculă de benzen este imposibil să distingem trei legături duble și trei simple. Densitatea electronică este distribuită uniform în moleculă și toate legăturile dintre atomii de carbon sunt exact aceleași. Prin urmare, trebuie să ne amintim că formula Kekule, care este adesea folosită pentru a descrie benzenul, este arbitrară și nu reflectă structura reală a moleculei sale.
Deci, compușii aromatici sunt cei ale căror molecule conțin o grupare ciclică stabilă cu un caracter special de legătură. Având o formulă moleculară care indică un grad ridicat de nesaturare, aceste substanțe însă nu reacționează ca nesaturate, ci intră predominant în reacții de substituție menținând în același timp sistemul aromatic.
OMOLOGII DE BENZEN,
ISOMERIE, NOMENCLATURĂ
Formula generală a seriei omoloage de hidrocarburi aromatice este C n H 2 n -2.
Cel mai apropiat omolog al benzenului este metilbenzenul. Mai des folosesc numele său trivial - toluen:

Benzenul și toluenul nu au izomeri aromatici. Aceste substanțe sunt caracterizate numai izomerie interclasă. Astfel, hidrocarburile non-ciclice neconvertibile care conțin două legături triple sau două duble și una triplă în moleculă corespund formulei moleculare C 6 H 6 și, prin urmare, sunt izomerice cu benzen, de exemplu:
![]()
![]()
Începând cu arenele cu opt atomi de carbon, apare posibilitatea de izomerie din cauza compoziţia şi aranjarea relativă a radicalilor hidrocarburi. Dacă doi substituenți sunt conectați la inelul benzenic, atunci aceștia pot fi în trei poziții diferite unul față de celălalt: unul lângă altul (această poziție este indicată de prefix orto-), printr-un atom de carbon ( meta-), și unul față de celălalt ( pereche-). Dimetilbenzenul, ale căror izomeri sunt dați mai jos, are o denumire banală xilen
Astfel, formula moleculară C8H8 corespunde la patru hidrocarburi aromatice izomerice:



Conceptul de „inel de benzen” necesită imediat decodare. Pentru a face acest lucru, este necesar să luăm în considerare cel puțin pe scurt structura moleculei de benzen. Prima structură a benzenului a fost propusă în 1865 de omul de știință german A. Kekule:
Cele mai importante hidrocarburi aromatice includ benzenul C6H6 şi omologii săi: toluenul C6H5CH3, xilenul C6H4 (CH3)2 etc.; naftalină C 10 H 8, antracen C 14 H 10 şi derivaţii acestora.
Atomii de carbon din molecula de benzen formează un hexagon plat obișnuit, deși este de obicei desenat ca unul alungit.
Structura moleculei de benzen a fost în cele din urmă confirmată de reacția de formare a acesteia din acetilenă. Formula structurală descrie trei legături simple și trei duble alternative carbon-carbon. Dar o astfel de imagine nu transmite adevărata structură a moleculei. În realitate, legăturile carbon-carbon din benzen sunt echivalente și au proprietăți care sunt diferite de cele ale legăturilor simple sau duble. Aceste caracteristici sunt explicate prin structura electronică a moleculei de benzen.
Structura electronică a benzenului
Fiecare atom de carbon dintr-o moleculă de benzen este într-o stare de hibridizare sp 2. Este conectat la doi atomi de carbon vecini și un atom de hidrogen prin trei legături σ. Rezultatul este un hexagon plat: toți cei șase atomi de carbon și toate legăturile σ C-C și C-H se află în același plan. Norul de electroni al celui de-al patrulea electron (electronul p), care nu este implicat în hibridizare, are forma unei gantere și este orientat perpendicular pe planul inelului benzenic. Astfel de nori de electroni p de atomi de carbon vecini se suprapun deasupra și sub planul inelului.

Ca rezultat, șase electroni p formează un nor de electroni comun și o singură legătură chimică pentru toți atomii de carbon. Două regiuni ale planului mare de electroni sunt situate de fiecare parte a planului de legătură σ.

Norul de electroni p determină o reducere a distanței dintre atomii de carbon. Într-o moleculă de benzen, acestea sunt aceleași și egale cu 0,14 nm. În cazul unei legături simple și duble, aceste distanțe ar fi de 0,154 și, respectiv, 0,134 nm. Aceasta înseamnă că nu există legături simple sau duble în molecula de benzen. Molecula de benzen este un ciclu stabil cu șase atomi de grupări CH identice situate în același plan. Toate legăturile dintre atomii de carbon din benzen sunt echivalente, ceea ce determină proprietățile caracteristice ale inelului benzenic. Acest lucru este reflectat cel mai precis de formula structurală a benzenului sub forma unui hexagon regulat cu un cerc în interior (I). (Cercul simbolizează echivalența legăturilor dintre atomii de carbon.) Cu toate acestea, formula lui Kekulé care indică legăturile duble (II) este, de asemenea, adesea folosită:

Inelul benzenic are un anumit set de proprietăți, care se numește în mod obișnuit aromaticitate.
Serii omoloage, izomerie, nomenclatură
În mod convențional, arenele pot fi împărțite în două rânduri. Primul include derivați de benzen (de exemplu, toluen sau bifenil), al doilea include arene condensate (polinucleare) (cea mai simplă dintre ele este naftalina):

Seria omoloagă a benzenului are formula generală C n H 2 n -6. Omologii pot fi considerați derivați de benzen în care unul sau mai mulți atomi de hidrogen sunt înlocuiți cu diverși radicali de hidrocarburi. De exemplu, C6H5-CH3-metilbenzen sau toluen, C6H4(CH3)2-dimetilbenzen sau xilen, C6H5-C2H5-etilbenzen etc.

Deoarece toți atomii de carbon din benzen sunt echivalenți, primul său omolog, toluenul, nu are izomeri. Al doilea omolog, dimetilbenzenul, are trei izomeri care diferă în pozițiile lor relative grupări metil(deputați). Acesta este un izomer orto- (abreviat o-) sau 1,2, în care substituenții sunt localizați pe atomii de carbon vecini. Dacă substituenții sunt separați de un atom de carbon, atunci este un meta- (abreviat m-) sau 1,3-izomer, iar dacă sunt separați de doi atomi de carbon, atunci este un para- (abreviat p-) sau 1,4-izomer. În nume, substituenții sunt desemnați prin litere (o-, m-, p-) sau numere.

Proprietăți fizice
Primii membri ai seriei omoloage de benzen sunt lichide incolore cu un miros specific. Densitatea lor este mai mică de 1 (mai ușoară decât apa). Insolubil în apă. Benzenul și omologii săi sunt ei înșiși solvenți buni pentru mulți materie organică. Arenele ard cu o flacără fumurie datorită conținutului ridicat de carbon din moleculele lor.
Proprietăți chimice
Aromaticitatea determină proprietățile chimice ale benzenului și ale omologilor săi. Sistemul π cu șase electroni este mai stabil decât legăturile π obișnuite cu doi electroni. Prin urmare, reacțiile de adiție sunt mai puțin frecvente pentru hidrocarburile aromatice decât pentru hidrocarburile nesaturate. Cele mai caracteristice reacții pentru arene sunt reacțiile de substituție. Astfel, hidrocarburile aromatice în felul lor proprietăți chimice ocupă o poziţie intermediară între hidrocarburile saturate şi nesaturate.
I. Reacţii de substituţie
1. Halogenare (cu Cl 2, Br 2)

2. Nitrarea

3. Sulfonare

4. Alchilare (se formează omologi de benzen) - reacții Friedel-Crafts

Alchilarea benzenului are loc și atunci când reacţionează cu alchenele:

Stirenul (vinilbenzenul) se obține prin dehidrogenarea etilbenzenului:

II. Reacții de adaos
1. Hidrogenarea

2. Clorarea

III. Reacții de oxidare
1. Arderea
2C 6 H 6 + 15O 2 → 12CO 2 + 6H 2 O
2. Oxidarea sub influența KMnO 4, K 2 Cr 2 O 7, HNO 3 etc.
Nu se întâmplă reacție chimică(asemănător cu alcanii).
Proprietățile omologilor benzenului
În omologii benzenului, se disting un miez și un lanț lateral (radicali alchil). Proprietățile chimice ale radicalilor alchil sunt similare cu alcanii; influența inelului benzenic asupra acestora se manifestă prin faptul că reacțiile de substituție implică întotdeauna atomi de hidrogen la atomul de carbon legați direct de inelul benzenic, precum și în oxidarea mai ușoară a legăturilor C-H.

Efectul unui radical alchil donator de electroni (de exemplu, -CH3) asupra inelului benzenic se manifestă printr-o creștere a sarcinilor negative efective asupra atomilor de carbon din pozițiile orto și para; ca urmare, înlocuirea atomilor de hidrogen asociați este facilitată. Prin urmare, omologii benzenului pot forma produse trisubstituite (iar benzenul formează de obicei derivați monosubstituiți).




