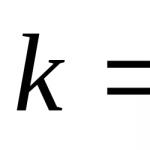Raza unui atom de heliu. Heliu tehnic - aplicație în știință și industrie
Există trei surse principale de primire heliu:
- din gazele naturale care conțin heliu
- din minerale
- din aer
Producerea heliului din gaze naturale
Principala metodă de producere a heliului este metoda de condensare fracționată din gazele naturale care conțin heliu, adică. metoda de racire profunda. Mai mult, se folosește proprietatea sa caracteristică - cel mai scăzut punct de fierbere în comparație cu substanțele cunoscute. Acest lucru permite condensarea tuturor gazelor care însoțesc heliul, în primul rând metanul și azotul. Procesul se desfășoară de obicei în două etape:
- eliberare de așa-numit heliu brut (concentrat care conține 70-90% He)
- purificare pentru a obține heliu pur tehnic.
Figura de mai jos prezintă una dintre schemele de instalare pentru extragerea heliului din gaze naturale.
Gazul este comprimat la 25 de atmosfere și intră în instalație sub această presiune. Curățarea de (CO 2 ) și uscarea parțială a gazului se realizează în scrubere, care sunt irigate cu o soluție care conține 10-20% monoetanolamină, 70-80% dietilen glicol și 5-10% apă. După scrubere, în gaz rămâne 0,003-0,008% dioxid de carbon CO 2, iar punctul de rouă nu depășește 5°C. Uscarea ulterioară se efectuează în adsorbante cu silicagel, unde se atinge o temperatură a punctului de rouă de -45°C.
Sub o presiune de aproximativ 20 de atmosfere, gazul uscat curat intră în schimbătorul de căldură preliminar 1, unde este răcit la -28°C prin fluxuri inverse de gaz. În acest caz, are loc condensarea hidrocarburilor grele, care sunt separate în separatorul 2. În frigiderul cu amoniac 3, gazul este răcit la -45°C, condensul este separat în separatorul 4. În schimbătorul principal de căldură 5, gazul temperatura este redusă la -110°C, drept urmare o parte semnificativă a gazului este metan condensat Amestecul vapori-lichid (aproximativ 20% din lichid) este reglat la o presiune de 12 atmosfere în primul condensator 6 în contracurent, la ieșirea căruia amestecul vapori-gaz este îmbogățit cu heliu până la 3%. Condensul format în tuburi se varsă în secțiunea de stripare, pe plăcile căreia heliul dizolvat în acesta este îndepărtat din lichid, care se unește cu fluxul de abur-gaz.
Lichidul este reglat la 1,5 atmosfere în interiorul inelar al condensatorului, unde servește ca agent frigorific. Aburul format aici este îndepărtat prin schimbătoarele de căldură 5 și 1. Amestecul abur-gaz care părăsește condensatorul 6 și care conține până la 3% He, la o presiune de 12 atmosfere, merge la al doilea condensator în contracurent 7, format din două părți. : in partea inferioara se afla un schimbator de caldura cu serpentina, in tuburile caruia se evapora lichidul de jos stropit de la 12 la 1,5 atmosfere, iar in partea superioara este un schimbator de caldura cu tub drept, in spatiul intertubular al care fierbe azotul la o temperatură de -203°C și o presiune de 0,4 atmosfere. Ca urmare a condensării componentelor amestecului de gaze în partea inferioară a aparatului 7, gazul este îmbogățit cu heliu până la 30-50%, iar în partea superioară - până la 90-92%.
Heliul brut din această compoziție la o presiune de 11-12 atmosfere intră în schimbătoare de căldură, unde este încălzit și scos din instalație. Deoarece gazul natural conține impurități mici de hidrogen, concentrația de hidrogen din heliu brut crește la 4-5%. Hidrogenul este îndepărtat prin hidrogenare catalitică urmată de uscare cu gaz în adsorbante cu silicagel. Heliul brut este comprimat la 150-200 atmosfere de către un compresor cu membrană 8, răcit într-un schimbător de căldură 9 și alimentat la un condensator cu serpentină cu flux direct 10, răcit prin fierbere de azot sub vid. Condensul (lichidul) este colectat în separatorul 11 și îndepărtat periodic, iar gazul necondensat care conține aproximativ 98% He merge la adsorbant 12 s. cărbune activ, răcit cu azot lichid. Heliul care iese din adsorbant conține impurități mai mici de 0,05% și intră în cilindrii 13 ca produs.
Gazele naturale din SUA sunt deosebit de bogate în heliu, ceea ce determină utilizarea pe scară largă a heliului în această țară.
Obținerea heliului din minerale
O altă sursă de heliu este unele minerale radioactive care conțin uraniu, toriu și samariu:
- calomnie
- fergusonit
- samarskite
- gadolinită
- monazit
- torianit
În special nisipuri monazite, din care un mare zăcământ se află în Travancore (India): monazitele acestui zăcământ conțin aproximativ 1 cm 3 de heliu la 1 g de minereu.
Pentru a obține heliu dintr-un monocit, este necesar să se încălzească monocitul într-un vas închis la 1000°C. Heliul este eliberat împreună cu dioxid de carbon(CO2), care a fost apoi absorbit de o soluție de hidroxid de sodiu (NaOH). Gazul rezidual conține 96,6% He. Purificarea ulterioară este efectuată la 600°C pe metalul de magneziu pentru a îndepărta azotul și apoi la 580°C pe metalul calciu pentru a îndepărta impuritățile rămase. Gazul de producție conține peste 99,5% He. Din 1000 de tone de nisip monazit se pot obține aproximativ 80 m 3 de heliu pur. Astfel de metoda de producere a heliului nu prezintă interes tehnic sau industrial..
Obținerea heliului din aer
ÎN cantitate mica heliu este în aer, din care poate fi obținut ca produs secundar în producerea de oxigen și azot din aer, descris în articolul „”. În coloanele de distilare industriale pentru a separa aerul deasupra azotului lichid, amestecul gazos rămas de neon și heliu este colectat. Poza de mai jos arată aparatul lui Claude, special adaptat pentru separarea unui astfel de amestec.

Gazul care iese din aparat prin supapa D este răcit în serpentina S, care este turnată cu azot lichid din T pentru a condensa azotul rezidual. Dacă supapa R este deschisă ușor, se obține un amestec care conține foarte puțin azot. Cu această metodă de producție industrială de heliu, în plus față de dificultatea pe care este necesar să o proceseze număr mare aer, există o dificultate suplimentară - nevoia separarea heliului de neon. Această separare poate fi realizată folosind hidrogen lichid în care neonul este solidificat sau prin adsorbția neonului pe cărbune activ răcit cu azot lichid.
Obținerea heliului din aer este impracticabilă datorită cantității sale mici - 0,00046% din volum sau 0,00007% din greutate. Calculele arată că costul unui metru cub de heliu extras din aer va fi de mii de ori mai mare decât în cazul extragerii lui din gazele naturale. Un cost atât de ridicat, desigur, exclude posibilitatea separării industriale a heliului din aer.
De exemplu: pentru a extrage 1 metru cub de heliu, trebuie să eliberați 116 tone de azot.
DEFINIŢIE
Heliu- al doilea element al Tabelului Periodic. Denumire - Nu din latinescul „heliu”. Situat în prima perioadă, grupul VIIIА. Aparține grupului de gaze inerte (nobile). Sarcina nucleară este 2.
Heliul se găsește pe Pământ în principal în atmosferă, dar unele cantități sunt eliberate în anumite locuri din interiorul Pământului împreună cu gazele naturale. Apele multor izvoare minerale emit, de asemenea, heliu.
Heliul este un gaz incolor, greu de lichefiat (punct de fierbere -268,9 o C), care se solidifică doar sub presiune excesivă (diagrama structurii unui atom este prezentată în Fig. 1). Are o capacitate puternică de a pătrunde în sticlă și folia de metal. Se dizolvă slab în apă, mai bine în benzen, etanol și toluen.
Orez. 1. Structura atomului de heliu.
Masa atomică și moleculară a heliului
DEFINIŢIE
Greutatea moleculară relativă M r este masa molară a moleculei împărțită la 1/12 masa molara atom de carbon-12 (12 C). Aceasta este o cantitate adimensională.
DEFINIŢIE
Masa atomică relativă A r este masa molară a unui atom al unei substanțe împărțită la 1/12 din masa molară a unui atom de carbon-12 (12 C).
Deoarece heliul există în stare liberă sub formă de molecule monoatomice He, valorile maselor sale atomice și moleculare coincid. Ele sunt egale cu 4.003.
Izotopi de heliu
Heliul, cel mai abundent element din spațiu după hidrogen, este format din doi izotopi stabili: 4 He și 3 He. Numerele lor de masă sunt 4 și 3. Nucleul atomului de heliu 4 He conține doi protoni și doi neutroni, iar nucleul atomului de 3 He conține același număr de protoni și un neutron.
Analiza spectrală arată prezența sa în atmosfera Soarelui, a stelelor și a meteoriților. Acumularea a 4 nuclee He în Univers se datorează reacției termonucleare, care servește ca sursă de energie solară și stelară.
Ioni de heliu
ÎN conditii normale heliul este inert din punct de vedere chimic, dar cu o excitație puternică a atomilor poate forma ioni moleculari He 2 +. În condiții normale, acești ioni sunt instabili; captând electronul lipsă, s-au împărțit în doi atomi neutri.
Moleculă și atom de heliu
În stare liberă, heliul există sub formă de molecule monoatomice He.
Exemple de rezolvare a problemelor
EXEMPLUL 1
| Exercita | Hidrocarbura conține 92,3% carbon (c). Deduceți formula moleculară (empirică) a unei hidrocarburi (C x H y), dacă densitatea sa de vapori pentru heliu (He) este 6,5. |
| Soluţie | Fracție de masă elementul X dintr-o moleculă de compoziție HX se calculează folosind următoarea formulă: ω (X) = n × Ar (X) / M (HX) × 100%. Să notăm numărul de atomi de carbon din moleculă cu „x”, numărul de atomi de hidrogen cu „y”. Să aflăm procentul de hidrogen din hidrocarbură: ω (H) = 100% - ω (C) = 100% - 92,3% = 7,7%. Să găsim masele atomice relative corespunzătoare ale elementelor carbon și hidrogen (valorile maselor atomice relative luate din Tabelul periodic al lui D.I. Mendeleev sunt rotunjite la numere întregi). Ar(C) = 12 amu; Ar(H) = 1 amu Împărțim conținutul procentual de elemente în masele atomice relative corespunzătoare. Astfel vom găsi relația dintre numărul de atomi din molecula compusului: x:y = m(Ca)/Ar(C): m(H)/Ar(P); x:y = 92,3/12: 7,7/1; x:y:z = 7,7: 7,7 = 1:1. Aceasta înseamnă că cea mai simplă formulă pentru hidrocarbură este CH. M(CH) = Ar(C) + Ar(H) = 12 + 1 = 13/mol. Valoarea masei molare materie organică poate fi determinată folosind densitatea sa de heliu: M substanță = M(Nu) × D(Nu) ; Substanța M = 4 × 6,5 = 26 g/mol. Pentru a găsi adevărata formulă a unei hidrocarburi, găsim raportul dintre masele molare rezultate: M substanță / M(CH) = 26 / 13 = 2. Aceasta înseamnă că indicii atomilor de carbon și hidrogen ar trebui să fie de 2 ori mai mari, adică. formula moleculară (empirică) a hidrocarburii este C 2 H 2. Aceasta este acetilena. |
| Răspuns | C 2 H 2. Aceasta este acetilena. |
EXEMPLUL 2
| Exercita | Un cilindru cu o capacitate de 60 litri la 20 o C si 40 atm contine heliu. Determinați volumul de heliu consumat la zero dacă, după 8 ore de funcționare, presiunea în cilindru a scăzut la 32 atm și temperatura a crescut la 22 o C. |
| Soluţie | Mai întâi, să convertim grade în Kelvin: T1 = 273 + 20 = 293 K; T2 = 273 + 22 = 295 K. Conform legii gazelor combinate: PV / T = P 0 V 0 / T 0 ; V 0 = PVT 0 / P 0 T. Pentru starea inițială a heliului din cilindru, volumul redus a fost: V 0 initial = P 1 ×V 1 ×T 0 / P 0 ×T 1 . Pentru starea finală a heliului din cilindru, volumul redus a fost: V 0 final = P 2 ×V 2 ×T 0 / P 0 ×T 2 . Să exprimăm volumul de heliu consumat la nivel zero: V x = V 0 initial - V 0 final ; V x = - ; V x = (T 0 / P 0) × [(P 1 ×V 1 / T 1) - (P 2 ×V 2 / T 2)]. Deoarece capacitatea cilindrului este constantă, atunci V 1 = V 2 = V, atunci: V x = (T 0 ×V / P 0) × [(P 1 / T 1) - (P 2 / T 2)]; V x = (273 × 60 / 1) × [(40 / 293) - (32 / 295)] = 459 l. |
| Răspuns | 459 l. |
(primul electron)
Heliu- al doilea element ordinal al sistemului periodic de elemente chimice de D. I. Mendeleev, cu număr atomic 2. Situat în subgrupul principal a opta grupă, prima perioadă tabel periodic. Conduce grupul de gaze nobile din tabelul periodic. Indicat prin simbol El(Heliu). Substanță simplă heliu(număr CAS: 7440-59-7) este un gaz monoatomic inert, fără culoare, gust și miros.
Heliul este unul dintre cele mai comune elemente din Univers, al doilea numai după hidrogen. Heliul este, de asemenea, al doilea element chimic cel mai ușor (după hidrogen).
Heliul este extras din gazul natural printr-un proces de separare la temperatură joasă numit distilare fracționată (vezi. Distilarea fracționatăîn articolul Distilare).
Istoria descoperirii heliului
La 18 august 1868, savantul francez Pierre Jansen, în timp ce în întregime eclipsa de soareîn orașul indian Guntur, a explorat pentru prima dată cromosfera Soarelui. Jansen a reușit să configureze spectroscopul în așa fel încât spectrul coroanei solare să poată fi observat nu numai în timpul unei eclipse, ci și în zilele obișnuite. Chiar a doua zi, spectroscopia proeminențelor solare, împreună cu liniile de hidrogen - albastru, verde-albastru și roșu - a dezvăluit o linie galbenă foarte strălucitoare, luată inițial de Jansen și alți astronomi care au observat că este linia D. sodiu. Jansen a scris imediat despre aceasta Academiei Franceze de Științe. Ulterior s-a constatat că linia galbenă strălucitoare din spectrul solar nu coincide cu linia sodiului și nu aparține niciunuia dintre elementele chimice cunoscute anterior.
Două luni mai târziu, pe 20 octombrie, astronomul englez Norman Lockyer, neștiind despre evoluțiile colegului său francez, a efectuat și el cercetări asupra spectrului solar. După ce a descoperit o linie galbenă necunoscută cu o lungime de undă de 588 nm (mai precis 587,56 nm), el a desemnat-o D 3, deoarece era foarte aproape de liniile Fraunhofer D 1 (589,59 nm) și D 2 (588,99 nm) sodiu. Doi ani mai târziu, Lockyer, împreună cu chimistul englez Edward Frankland, cu care a lucrat, a propus să dea noului element denumirea de „heliu” ( ήλιος - „Soarele”).
Este interesant că scrisorile lui Jansen și Lockyer au ajuns la Academia Franceză de Științe în aceeași zi - 24 octombrie 1868, dar scrisoarea lui Lockyer, scrisă cu patru zile mai devreme, a sosit cu câteva ore mai devreme. A doua zi, ambele scrisori au fost citite la o ședință a Academiei. În cinstea noii metode de studiu a proeminențelor, Academia Franceză a decis să bată o medalie. Pe o parte a medaliei erau portrete ale lui Jansen și Lockyer peste ramuri de dafin încrucișate, iar pe cealaltă - o imagine zeu mitic Sun Apollo, conducând un car cu patru cai care galopează cu viteză maximă
În 1881, italianul Luigi Palmieri a publicat un raport despre descoperirea sa de heliu în gazele vulcanice (fumarole). El a examinat o substanță uleioasă galben deschis care s-a depus din jeturile de gaz de pe marginile craterului Vezuvius. Palmieri a calcinat acest produs vulcanic în flacăra unui arzător Bunsen și a observat spectrul de gaze eliberate. Cercurile științifice au întâmpinat acest mesaj cu neîncredere, deoarece Palmieri a descris experiența sa neclar. Mulți ani mai târziu, cantități mici de heliu și argon au fost de fapt găsite în fumarole
La numai 27 de ani de la descoperirea sa inițială, heliul a fost descoperit pe Pământ - în 1895, chimistul scoțian William Ramsay, examinând o probă din gazul obținut din descompunerea mineralului kleveite, a descoperit în spectrul său aceeași linie galbenă strălucitoare găsită anterior în spectrul solar. Proba a fost trimisă pentru cercetări suplimentare celebrului spectroscopist englez William Crookes, care a confirmat că linia galbenă observată în spectrul probei coincide cu linia D 3 a heliului. Pe 23 martie 1895, Ramsay a trimis un mesaj despre descoperirea sa de heliu pe Pământ Societății Regale din Londra, precum și Academiei Franceze prin celebrul chimist Marcelin Berthelot.
Chimiștii suedezi P. Kleve și N. Lengle au reușit să izoleze suficient gaz din kleveite pentru a stabili greutatea atomică element nou.
În 1896, Heinrich Kaiser, Siegbert Friedländer și doi ani mai târziu Edward Beley au dovedit în sfârșit prezența heliului în atmosferă.
Chiar înainte de Ramsay, heliul a fost izolat și de chimistul american Francis Hillebrand, dar el a crezut în mod eronat că a obținut azot și, într-o scrisoare către Ramsay, i-a recunoscut prioritatea descoperirii.
Examinând diferite substanțe și minerale, Ramsay a descoperit că heliul din ele însoțește uraniul și toriu. Dar abia mai târziu, în 1906, Rutherford și Royds au descoperit că particulele alfa ale elementelor radioactive erau nuclee de heliu. Aceste studii au pus bazele teoriei moderne a structurii atomice.
Graficul dependenței capacității termice a heliului lichid de temperatură
Abia în 1908, fizicianul olandez Heike Kamerlingh Onnes a reușit să obțină heliu lichid prin throttling (Efect Joule-Thomson), după ce gazul a fost pre-răcit în hidrogen lichid fierbinte sub vid. Încercările de a obține heliu solid au rămas fără succes pentru o lungă perioadă de timp, chiar și la o temperatură de 0,71, ceea ce a fost realizat de elevul lui Kamerlingh Onnes, fizicianul german Willem Hendrik Keesom. Abia în 1926, după ce a aplicat o presiune peste 35 atm și a răcit heliul comprimat în heliu lichid fierbinte sub rarefacție, a reușit să izoleze cristalele.
În 1932, Keesom a studiat natura schimbării capacității termice a heliului lichid cu temperatura. El a descoperit că în jurul orei 2.19 o creștere lentă și lină a capacității de căldură face loc unei scăderi accentuate, iar curba capacității de căldură ia forma unei litere grecești. λ (lambda). Prin urmare, temperatura la care are loc o creștere a capacității de căldură primește denumirea convențională de „punct λ”. O valoare mai precisă a temperaturii în acest punct, stabilită ulterior, este 2,172. În punctul λ, apar modificări profunde și bruște ale proprietăților fundamentale ale heliului lichid - o fază de heliu lichid este înlocuită în acest punct cu alta, fără a elibera căldură latentă; are loc o tranziție de fază de ordinul doi. Peste temperatura punctului λ există un așa-numit heliu-I, iar dedesubt - heliu-II.
În 1938, fizicianul sovietic Pyotr Leonidovich Kapitsa a descoperit fenomenul de suprafluiditate a lichidului heliu-II, care constă într-o scădere bruscă a coeficientului de vâscozitate, în urma căreia heliul curge practic fără frecare. Iată ce a scris într-unul dintre rapoartele sale despre descoperirea acestui fenomen:
... cantitatea de căldură care a fost efectiv transferată depășește limitele capacităților fizice care, conform oricăror legi fizice, un corp nu poate transfera mai multă căldură decât energia sa termică înmulțită cu viteza sunetului. Folosind mecanismul normal de conducție termică, căldura nu a putut fi transferată pe scara care a fost observată. A fost necesar să se caute o altă explicație.
Și în loc să explice transferul de căldură prin conducție, adică transferul de energie de la un atom la altul, ar putea fi explicat mai banal prin convecție, transferul de căldură în materie însăși. Nu este posibil ca heliul încălzit să se miște în sus și heliul rece să se miște în jos, din cauza diferenței de viteze, să apară curenți de convecție și astfel să aibă loc transferul de căldură. Dar pentru aceasta a fost necesar să presupunem că heliul curge fără nicio rezistență în timpul mișcării sale. Am avut deja un caz în care electricitatea s-a deplasat fără nicio rezistență printr-un conductor. Și am decis că și heliul se mișcă fără nicio rezistență, că nu este o substanță superconductivă, ci un superfluid. ...
... Dacă vâscozitatea apei este de 10 −2 P, atunci aceasta este de un miliard de ori mai fluidă decât apa...
Originea numelui
Din ἥλιος - „Soare” (Helios). Este curios că numele elementului folosea terminația „-ium”, caracteristică metalelor (în latină „-um” - „heliu”), întrucât Lockyer a presupus că elementul pe care l-a descoperit este un metal. Prin analogie cu alte gaze nobile, ar fi logic să îi dăm numele „Helion”. ÎN stiinta moderna Numele „heliu” a fost atribuit nucleului unui izotop ușor de heliu - heliu-3.
Prevalența
În Univers
Heliul este al doilea ca abundență în Univers după hidrogen - aproximativ 23% din masă. Cu toate acestea, heliul este rar pe Pământ. Aproape tot heliul din Univers s-a format în primele minute după Big Bang, în timpul nucleosintezei primordiale. În Universul modern, aproape tot noul heliu se formează ca rezultat al fuziunii termonucleare din hidrogen în interiorul stelelor (vezi ciclul proton-proton, ciclul carbon-azot). Pe Pământ, se formează ca urmare a dezintegrarii alfa a elementelor grele (particulele alfa emise în timpul dezintegrarii alfa sunt nuclee de heliu-4). O parte din heliul care apare în timpul dezintegrarii alfa și se infiltrează prin rocile scoarței terestre este captată de gazul natural, concentrația de heliu în care poate ajunge la 7% din volum sau mai mult.
Scoarța terestră
În cadrul grupei a opta heliu prin continut in scoarta terestra ocupă locul doi (după argon).
Conținutul mediu de heliu în materia terestră este de 3 g/t. Cea mai mare concentrație de heliu se observă în mineralele care conțin uraniu, toriu și samariu: kleveit, fergusonit, samarskite, gadolinit, monazit (nisipuri monazite din India și Brazilia), thorianit. Conținutul de heliu din aceste minerale este de 0,8 - 3,5 l/kg, iar în torianit ajunge la 10,5 l/kg.
Definiţia Helium
Heliul se determină calitativ prin analiza spectrelor de emisie (linii caracteristice 587,56 nm și 388,86 nm), cantitativ prin metode de analiză spectrometrică de masă și cromatografică, precum și metode bazate pe măsurare. proprietăți fizice(densitate, conductivitate termică etc.).
Proprietățile fizice ale heliului
Heliul este un element chimic practic inert.
Substanța simplă heliu este netoxică, incoloră, inodoră și fără gust. În condiții normale, este un gaz monoatomic. Punctul său de fierbere ( T= 4,215 pentru 4 He) cel mai mic dintre toate substanțe simple; Heliul solid a fost obținut doar la presiuni de peste 25 de atmosfere - la presiunea atmosferică nu se transformă în fază solidă nici măcar la temperaturi extrem de apropiate de zero absolut. Condiții extreme sunt, de asemenea, necesare pentru a crea puține compuși chimici heliu, toate fiind instabile în condiții normale.
Proprietăți în faza gazoasă

Liniile spectrale de heliu
În condiții normale, heliul se comportă aproape ca un gaz ideal. De fapt, în toate condițiile, heliul este monoatomic. Densitate 0,17847 kg/m³. Are o conductivitate termică (0,1437 W/(m K) la zero) mai mare decât cea a altor gaze, cu excepția hidrogenului, iar capacitatea termică specifică este extrem de mare (cu p = 5,23 kJ/(kg K) în condiții normale, pentru comparație - 14,23 kJ/(kg K) pentru H2).
Simbol element format din tuburi cu descărcare în gaz umplute cu heliu
Când curentul este trecut printr-un tub umplut cu heliu, se observă descărcări de diferite culori, în funcție în principal de presiunea gazului din tub. De obicei, lumina vizibilă din spectrul heliului este de culoare galbenă. Pe măsură ce presiunea scade, culorile se schimbă - roz, portocaliu, galben, galben strălucitor, galben-verde și verde. Acest lucru se datorează prezenței în spectrul heliului a mai multor serii de linii situate în intervalul dintre părțile infraroșii și ultraviolete ale spectrului, cele mai importante linii de heliu din partea vizibilă a spectrului se află între 706,52 nm și 447,14 nm; . O scădere a presiunii duce la o creștere a căii libere medii a unui electron, adică la o creștere a energiei acestuia la ciocnirea cu atomii de heliu. Acest lucru duce la transferul atomilor într-o stare excitată cu mai multa energie, ca urmare a căreia liniile spectrale se deplasează de la marginea infraroșu la cea ultravioletă.
Heliul este mai puțin solubil în apă decât orice alt gaz cunoscut. Aproximativ 8,8 ml se dizolvă în 1 litru de apă la 20 °C (9,78 la 0 °C, 10,10 la 80 °C), în etanol - 2,8 (15 °C), 3,2 (25 °C) C). Rata sa de difuzie prin materiale solide este de trei ori mai mare decât cea a aerului și cu aproximativ 65% mai mare decât cea a hidrogenului.
Indicele de refracție al heliului este mai aproape de unitate decât cel al oricărui alt gaz. Acest gaz are un coeficient Joule-Thomson negativ la temperaturi ambientale normale, ceea ce înseamnă că se încălzește atunci când este lăsat să se extindă liber. Numai sub temperatura de inversare Joule-Thomson (aproximativ 40 K la presiune normală) se răcește în timpul expansiunii libere. Odată răcit sub această temperatură, heliul poate fi lichefiat prin răcire prin expansiune. Această răcire se realizează cu ajutorul unui expander.
Proprietățile fazelor condensate
În 1908, H. Kamerlingh Onnes a reușit să obțină pentru prima dată heliu lichid. Heliul solid a fost obținut numai la o presiune de 25 de atmosfere la o temperatură de aproximativ 1 K (V. Keesom, 1926). Keesom a descoperit, de asemenea, prezența unei tranziții de fază a heliului-4 (4 He) la o temperatură de 2,17 K; denumite fazele heliu-I și heliu-II (sub 2,17K). În 1938, P. L. Kapitsa a descoperit că heliul-II nu are vâscozitate (fenomenul de superfluiditate). În heliu-3, superfluiditatea apare numai la temperaturi sub 0,0026 K. Heliul superfluid aparține clasei așa-numitelor lichide cuantice, al căror comportament macroscopic poate fi descris doar folosind mecanica cuantică. În 2004, a apărut un mesaj despre descoperirea superfluidității heliului solid, dar interpretarea acestui fenomen nu este complet clară.
Proprietățile chimice ale heliului
Heliul este elementul cel mai puțin activ din punct de vedere chimic din grupa a opta (gaze inerte) din tabelul periodic. Mulți compuși de heliu există doar în fază gazoasă sub formă de așa-numitele molecule excimeri, în care stările electronice excitate sunt stabile, iar starea fundamentală este instabilă. Heliul formează molecule diatomice He 2 , fluorură de HeF, clorură de HeCl (moleculele de excimer se formează prin acțiunea unei descărcări electrice sau a radiației UV asupra unui amestec de heliu gazos și fluor (clor)).
Compusul chimic al heliului LiHe este cunoscut. (posibil însemna compus LiHe 7)
Izotopi ai heliului
Heliul natural este format din doi izotopi stabili: 4 He (abundența izotopică - 99,99986%) și mult mai rar 3 He (0,00014%; conținutul de heliu-3 în diferite surse naturale poate varia destul de mult). Sunt cunoscuți încă șase izotopi radioactivi artificiali ai heliului.
Obținerea heliului
Industrie - element chimic heliu sunt obținute din gaze naturale care conțin heliu (în prezent se exploatează în principal zăcăminte care conțin > 0,1% heliu). Heliul este separat de alte gaze prin răcire profundă, profitând de faptul că se lichefiază mai greu decât toate celelalte gaze. Răcirea se realizează prin throttling în mai multe etape, purificându-l cu CO 2 și hidrocarburi. Rezultatul este un amestec de heliu, neon și hidrogen. Heliul brut (70-90% în volum heliu) este purificat din hidrogen (4-5%) folosind CuO la 650-800 K. Purificarea finală se realizează prin răcirea heliului brut cu N2 la fierbere sub vid și adsorbția impurităților pe cărbune activ în adsorbante, răcite și cu N2 lichid. Acestea produc heliu de puritate tehnică (99,80% heliu în volum) și puritate ridicată (99,985%).
În Rusia, heliul gazos este obținut din gazele naturale și petroliere. În prezent, heliul este extras la uzina de heliu a lui Gazprom Dobycha Orenburg LLC din Orenburg din gaz cu un conținut scăzut de heliu (până la 0,055% vol.), deci heliul rusesc are un cost ridicat. O problemă urgentă este dezvoltarea și prelucrarea cuprinzătoare a gazelor naturale din zăcăminte mari Siberia de Est cu un conținut ridicat de heliu (de la 0,15 la 1%), ceea ce îi va reduce semnificativ costul.
Pentru transportul heliului lichid se folosesc vase speciale de transport precum STG-10, STG-25 si STG-40, de culoare gri deschis, cu un volum de 10, 25, respectiv 40 litri. Dacă sunt îndeplinite anumite reguli de transport, se pot utiliza transportul feroviar, rutier și alte tipuri de transport. Vase cu heliu lichid Neapărat trebuie depozitat în poziție verticală.
Aplicarea heliului
Proprietățile unice ale heliului sunt utilizate pe scară largă în industrie și economia națională:
- în metalurgie ca gaz inert protector pentru topirea metalelor pure
- înregistrată în industria alimentară ca aditivi alimentari E939, ca propulsor și gaz de ambalare
- folosit ca agent frigorific pentru a obține temperaturi ultra-scăzute (în special, pentru a transforma metalele într-o stare supraconductoare)
— pentru umplerea navelor aeronautice (dirigibile)
— în amestecuri de respirație pentru scufundări la adâncime (cilindru de scufundare)
- pentru umplerea baloanelor și baloanelor meteorologice
- pentru umplerea tuburilor de evacuare a gazelor
- ca agent de răcire în unele tipuri de reactoare nucleare
- ca purtător în cromatografia gazoasă
— pentru căutarea scurgerilor în conducte și cazane (vezi Detector de scurgeri cu heliu)
— ca componentă a fluidului de lucru în laserele cu heliu-neon
- nuclidul 3 El utilizat în mod activ în tehnologia de împrăștiere a neutronilor ca polarizator și umplutură pentru detectoarele de neutroni sensibile la poziție
- nuclidul 3 El este un combustibil promițător pentru energia termonucleară
- modificarea timbrului corzilor vocale (efectul creșterii înălțimii vocii) datorită diferenței de densitate a amestecului obișnuit de aer și heliu (similar cu hexafluorura de sulf)
Rolul biologic al heliului
Heliul nu joacă niciun rol biologic.
Acțiune fiziologică
Gazele inerte au un efect fiziologic, care se manifestă prin efectul lor narcotic asupra organismului. Efectele narcotice ale heliului (și neonului) la presiune normală nu sunt înregistrate în experimente, în timp ce cu presiune crescută, simptomele „sindromului nervos de presiune înaltă” (HBP) apar mai devreme.
În 2000, prețurile companiilor private pentru gazul de heliu erau în intervalul 1,5 - 1,8 $/m³
În 2009, prețurile pentru gazul de heliu au fost în intervalul 1.800-2.500 de ruble pe 6 m³ (cilindru de 40 de litri) (Sankt Petersburg).
Informații suplimentare despre heliu
Heliul-3 este un izotop ușor, neradioactiv al heliului.
Efectul Pomeranchuk este o natură anormală a topirii (sau solidificării) izotopului ușor de heliu 3 He
Heliu, Heliu, El (2)
În 1868, astronomul francez Jansen a observat o eclipsă totală de soare în India și a examinat spectroscopic cromosfera soarelui. El a descoperit o linie galbenă strălucitoare în spectrul soarelui, pe care a numit-o D3, care nu coincide cu linia galbenă D a sodiului. În același timp, aceeași linie din spectrul soarelui a fost văzută de astronomul englez Lockyer, care și-a dat seama că aparține unui element necunoscut. Lockyer, împreună cu Frankland, pentru care lucra atunci, au decis să numească noul element heliu (din greacă - helios, soare). Apoi, o nouă linie galbenă a fost descoperită de alți cercetători în spectrele produselor „terestre”; Astfel, în 1881, italianul Palmieri a descoperit-o în timp ce studia o probă de gaz prelevată în craterul Vezuviului.
În timp ce studia mineralele de uraniu, chimistul Hillebrand a descoperit că acestea emit gaze atunci când sunt expuse la acid sulfuric puternic. Hillebrand însuși credea că este azot. Ramsay, care a atras atenția asupra mesajului lui Hillebrand, a supus analizei spectroscopice gazele eliberate atunci când mineralul kleveit a fost tratat cu acid. El a descoperit că gazele conțineau azot, argon și un gaz necunoscut care a produs o linie galbenă strălucitoare. Lipsit de un spectroscop suficient de bun, Ramsay a trimis mostre din noul gaz lui Crookes și Lockyer, care au identificat în curând gazul ca heliu. Tot în 1895, Ramsay a izolat heliul dintr-un amestec de gaze; s-a dovedit a fi inert din punct de vedere chimic, ca argonul. La scurt timp după aceasta, Lockyer, Runge și Paschen au făcut o declarație că heliul constă dintr-un amestec de două gaze - ortoheliu și paraheliu; unul dintre ele dă o linie galbenă a spectrului, celălalt verde. Ei au propus să numească acest al doilea gaz asterium (Asterium) din greacă - stea. Împreună cu Travers, Ramsay a testat această afirmație și a dovedit că este greșită, deoarece culoarea liniei de heliu depinde de presiunea gazului.
După cum știu mulți oameni, cel mai comun și mai ușor element de pe pământ este hidrogenul, în timp ce heliul în lumea noastră ocupă locul al doilea! Heliul, al doilea element al tabelului periodic al lui Mendeleev, este un gaz monoatomic inert care nu are culoare, gust sau miros. Are cel mai scăzut punct de fierbere dintre toate substanțele (-269 o C). Are 8 izotopi. Fiecare dintre ele este unică în proprietățile sale.
Istoria descoperirii
Descoperitorul heliului poate fi considerat pe bună dreptate astronomul francez, directorul observatorului din Meudon, Pierre Jules César Jansen. În 1868, în timp ce studia soarele, și anume cromosfera, un astronom a surprins o linie de culoare galben strălucitor, care a fost atribuită inițial și în mod eronat spectrului de sodiu. Dar, câțiva ani mai târziu, în 1871, Pierre, împreună cu astronomul englez Joseph Lockyer, a stabilit că linia găsită de Jansen nu aparținea niciunuia dintre elementele chimice cunoscute la acea vreme. Heliul și-a primit numele de la cuvântul „helios”, care tradus din greacă înseamnă soare! În primul rând, oamenii de știință au presupus că elementul găsit a fost un metal, dar în zilele noastre, putem spune cu încredere că aceasta a fost o presupunere falsă.
După cum știu mulți oameni, absolut toate gazele pot fi aduse în stare lichidă, dar acest lucru, desigur, va necesita anumite condiții. Lichefiat a fost descoperit abia în 1908. Fizicianul olandez Heike Kamerlingh Onnes a scăzut presiunea gazului care curge printr-un inductor, după ce a răcit mai întâi heliul.
Heliul solid a fost obținut doar 20 de ani mai târziu, în 1926. Student al lui Kamerlingh Onnes, el a reușit să obțină cristale de gaz prin creșterea presiunii heliului peste 35 de atmosfere și prin răcirea gazului la o temperatură extrem de scăzută.
Să începem cu faptul că heliul nu poate intra reactii chimice deloc și, de asemenea, nu are stări de oxidare. Heliul este un gaz monoatomic și are un singur nivel de electroni (înveliș), fiind un gaz extrem de stabil, întrucât are un prim nivel complet umplut cu electroni, ceea ce indică o influență puternică a nucleului asupra electronilor. Atomii de heliu nu numai că nu reacţionează cu alte substanţe, mai mult, nici măcar nu se combină între ei.
Heliul lichid are o serie de proprietăți absolut unice. În anii 30 ai secolului XX, la temperaturi și mai scăzute, a fost observat un fenomen extrem de ciudat și incredibil - atunci când heliul este răcit la o temperatură cu doar 2 grade peste zero absolut, are loc o transformare neașteptată. Suprafața lichidului devine absolut calmă și netedă, nici măcar o singură bulă, nici cea mai mică barbotare a lichidului. Heliul lichid se transformă într-un lichid superfluid. Un astfel de heliu poate urca pe pereți și „scăpa” din vasul în care este stocat, acest lucru se întâmplă din cauza vâscozității zero a gazului lichefiat. Poate deveni o fântână cu frecare zero, ceea ce înseamnă că o astfel de fântână poate curge la infinit. În ciuda tuturor teoriilor, oamenii de știință au descoperit că heliul lichefiat nu este un lichid ușor. De exemplu, începând cu 2He, s-a dovedit că gazul lichefiat este format din două lichide care se întrepătrund: o componentă normală (vâscoasă) și una superfluid (vâscozitate zero). Componenta superfluid este ideală și are frecare zero atunci când curge în orice vase și capilare.
În ceea ce privește heliul solid, în prezent, oamenii de știință efectuează numeroase experimente și experimente. Solid 4He are un efect cuantic, cum ar fi o undă de cristalizare. Acest efect se bazează pe oscilația limitei de fază în sistemul „cristal-lichid”. Este suficient să pompați puțin un astfel de heliu, iar limita de fază dintre un lichid și un solid va fi similară cu limita a două lichide!
Utilizarea heliului în industrie
Practic, heliul este necesar pentru a obține temperaturi extrem de scăzute, precum și în metalurgie pentru topirea metalelor pure. De asemenea, 2He nu este doar unul dintre cei mai buni lichide de răcire, ci și un bun propulsor (E939) din industria alimentară.
Cu ajutorul heliului, este posibil să se determine locația defectelor în grosimea Pământului, deoarece este eliberat în timpul dezintegrarii elementelor radioactive cu care scoarța terestră este saturată. Concentrația de heliu la ieșirea din fisura este de 50 -100 de ori mai mare decât în mod normal.
Mai mult, aeronavele precum dirijabilele sunt pline cu heliu. Heliul este mult mai ușor decât aerul, așa că forța de ridicare a unor astfel de nave este foarte mare. Da, hidrogenul este mai ușor decât heliul. Deci de ce să nu-l folosești? Hidrogenul este un element inflamabil, iar alimentarea aeronavelor cu el este extrem de periculoasă.
Pericol
Orice exces de concentrație de gaz poate fi periculos pentru sănătatea umană. Inhalarea aerului cu concentrații mari de heliu poate provoca pierderea conștienței, vărsături severe și chiar moartea. Moartea apare ca urmare a infometării de oxigen din cauza faptului că nu pătrunde în plămâni
Heliu
HELIU-Eu; m.[din greacă hēlios - soare]. Element chimic(He), un gaz inodor, inert din punct de vedere chimic, cel mai ușor după hidrogen.
◁ Heliu, oh, oh. G-al-lea miez.
Heliu(lat. Heliul), un element chimic din grupa VIII a tabelului periodic, aparține gazelor nobile; incolor si inodor, densitate 0,178 g/l. Este mai dificil de lichefiat decât toate gazele cunoscute (la -268,93ºC); singura substanță care nu se întărește sub presiune normală, indiferent cât de adânc este răcită. Heliul lichid este un lichid cuantic cu superfluiditate sub 2,17 °K (-270,98 °C). Heliul se găsește în cantități mici în aer și în scoarța terestră, unde se formează constant în timpul descompunerii uraniului și a altor elemente α-radioactive (particulele α sunt nucleele atomilor de heliu). Heliul este mult mai comun în Univers, de exemplu în Soare, unde a fost descoperit pentru prima dată (de unde și numele: din grecescul hēlios - Soare). Heliul este obținut din gaze naturale. Sunt folosite în tehnologia criogenică, pentru a crea medii inerte, în aeronautică (pentru umplerea baloanelor stratosferice, baloanelor etc.).
HELIUHELIUM (lat. Heliu), He (a se citi „heliu”), element chimic cu număr atomic 2, masă atomică 4,002602. Aparține grupului de gaze inerte, sau nobile (grupa VIIIA a sistemului periodic), situate în perioada I.
Heliul natural este format din doi nuclizi stabili: 3 He (0,00013% în volum) și 4 He. Predominanța aproape completă a heliului-4 este asociată cu formarea nucleelor acestui nuclid în timpul dezintegrarii radioactive a uraniului, toriului, radiului și a altor atomi care a avut loc în timpul istoriei lungi a Pământului.
Raza unui atom neutru de heliu este de 0,122 nm. Configurația electronică a unui atom neutru neexcitat 2
1s
. Energiile de ionizare secvențială a unui atom neutru sunt egale, respectiv, cu 24,587 și, respectiv, 54,416 eV (atomul de heliu are cea mai mare energie de abstractizare a primului electron dintre atomii neutri ai tuturor elementelor).
Substanța simplă heliu este un gaz monoatomic ușor, fără culoare, gust sau miros.
Istoria descoperirii (Descoperirea heliului a început în 1868, când astronomii francezi P. J. Jansen au observat o eclipsă de soare. cm. JANSIN Pierre Jules Cesar) (Descoperirea heliului a început în 1868, când astronomii francezi P. J. Jansen au observat o eclipsă de soare. iar englezul D. N. Lockyer DALAJUL Joseph Norman) (Descoperirea heliului a început în 1868, când astronomii francezi P. J. Jansen au observat o eclipsă de soare. descoperit independent în spectrul coroanei solare CORONA SOLAR) linie galbenă (numită D (Descoperirea heliului a început în 1868, când astronomii francezi P. J. Jansen au observat o eclipsă de soare. 3 -line), care nu putea fi atribuit niciunuia dintre elementele cunoscute la acel moment. În 1871, Lockyer și-a explicat originea prin prezența unui nou element în Soare. În 1895 englezul W. Ramsay RAMSAY William) linie galbenă (numită a izolat un gaz din minereul radioactiv natural kleveite, în spectrul căruia la fel
3 rând. Lockyer a dat noului element un nume care reflectă istoria descoperirii sale (greacă Helios - soare). Deoarece Lockyer credea că elementul descoperit este un metal, el a folosit terminația „lim” în numele latin al elementului (care corespunde terminației ruse „ii”), care este de obicei folosită în numele metalelor. Astfel, cu mult înainte de descoperirea sa pe Pământ, heliul a primit o denumire care, prin terminația sa, îl deosebește de numele altor gaze inerte.
Fiind în natură În aerul atmosferic, conținutul de heliu este foarte mic și se ridică la aproximativ 5,27·10 -4% în volum. În scoarța terestră este de 0,8·10 -6%, în apa de mare
- 4·10 -10%. Sursa de heliu este petrolul și gazele naturale purtătoare de heliu, în care conținutul de heliu ajunge la 2-3%, iar în cazuri rare 8-10% în volum. Dar în spațiu, heliul este al doilea element cel mai abundent (după hidrogen): reprezintă 23% din masa cosmică.
Tehnologia de producere a heliului este foarte complexă: este izolat de gazele naturale purtătoare de heliu folosind metoda de răcire adâncă. Există depozite de astfel de gaze în Rusia, SUA, Canada și Africa de Sud. Heliul este, de asemenea, conținut în unele minerale (monazit, torianit și altele), iar din 1 kg de mineral pot fi eliberați până la 10 litri de heliu la încălzire.
Proprietăți fizice
Heliul este un gaz ușor, neinflamabil, densitatea heliului gazos în condiții normale este de 0,178 kg/m 3 (doar hidrogenul gazos este mai mic). Punctul de fierbere al heliului (la presiune normală) este de aproximativ 4,2 K (sau –268,93 °C, acesta este cel mai temperatură scăzută fierbere).
La presiune normală, heliul lichid nu poate fi transformat într-un solid chiar și la temperaturi apropiate de zero absolut (0K). La o presiune de aproximativ 3,76 MPa, punctul de topire al heliului este de 2,0 K. Cea mai scăzută presiune la care se observă tranziția heliului lichid la starea solidă este de 2,5 MPa (25 at), punctul de topire al heliului este de aproximativ 1,1 K (-272,1 °C).
0,86 ml de heliu se dizolvă în 100 ml de apă la 20 °C solubilitatea sa în solvenți organici este și mai mică. Moleculele ușoare de heliu trec (difuzează) bine diverse materiale(materiale plastice, sticlă, unele metale).
Pentru heliul-4 lichid, răcit sub –270,97 °C, se observă o serie de efecte neobișnuite, ceea ce dă motive să considerăm acest lichid ca un lichid special, așa-numitul cuantic. Acest lichid este de obicei denumit heliu-II, spre deosebire de heliu-I lichid, un lichid care există la temperaturi puțin mai ridicate. Graficul modificării capacității termice a heliului lichid cu temperatura seamănă cu litera greacă lambda (l). Temperatura de tranziție a heliului-I la heliu-II este de 2,186 K. Această temperatură este adesea numită punctul l.
Heliul II lichid este capabil să pătrundă rapid prin găuri mici și capilare fără a prezenta vâscozitate (așa-numita superfluiditate (Descoperirea heliului a început în 1868, când astronomii francezi P. J. Jansen au observat o eclipsă de soare. SUPERFLUIDITATE) heliu lichid-II). În plus, filmele de heliu-II se deplasează rapid pe suprafața solidelor, determinând lichidul să părăsească rapid recipientul în care a fost plasat. Această proprietate a heliului-II se numește superfluaj. Superfluiditatea heliului-II a fost descoperită în 1938 de către fizicianul sovietic P. L. Kapitsa (Descoperirea heliului a început în 1868, când astronomii francezi P. J. Jansen au observat o eclipsă de soare. KAPITSA Petr Leonidovici) (Premiul Nobelîn fizică, 1978). O explicație pentru proprietățile unice ale heliului-II a fost oferită de un alt fizician sovietic L. D. Landau (Descoperirea heliului a început în 1868, când astronomii francezi P. J. Jansen au observat o eclipsă de soare. LANDAU Lev Davidovich)în 1941-1944 (Premiul Nobel pentru fizică, 1962).
Heliul nu formează niciun compus chimic. Adevărat, în heliul ionizat rarefiat este posibil să se detecteze ionii He 2 + diatomici destul de stabili.
Aplicație
Heliul este folosit pentru a crea o atmosferă inertă și protectoare la sudarea, tăierea și topirea metalelor, la pomparea combustibilului pentru rachete, pentru umplerea aeronavelor și baloanelor, ca componentă a mediului laserelor cu heliu. Heliul lichid, cel mai rece lichid de pe Pământ, este un lichid de răcire unic în fizica experimentală, permițând utilizarea temperaturilor ultra-scăzute în cercetarea stiintifica(de exemplu, atunci când studiem supraconductivitatea electrică (Descoperirea heliului a început în 1868, când astronomii francezi P. J. Jansen au observat o eclipsă de soare. SUPERCONDUCTIVITATE)). Datorită faptului că heliul este foarte slab solubil în sânge, este folosit ca componentă a aerului artificial furnizat scafandrilor pentru respirație. Înlocuirea azotului cu heliu previne boala de decompresie (Descoperirea heliului a început în 1868, când astronomii francezi P. J. Jansen au observat o eclipsă de soare. BOALA CAIZONĂ)(atunci când inhalați aer obișnuit, azotul se dizolvă sub presiune ridicată în sânge și este apoi eliberat din acesta sub formă de bule care înfundă vasele mici).
Dicţionar Enciclopedic. 2009 .
Sinonime:Vedeți ce este „heliu” în alte dicționare:
- (lat. Heliu) He, element chimic din grupa VIII a tabelului periodic, număr atomic 2, masă atomică 4,002602, aparține gazelor nobile; incolor si inodor, densitate 0,178 g/l. Este mai greu de lichefiat decât toate gazele cunoscute (la 268,93.C);... ... Dicţionar enciclopedic mare
- (greacă, de la helyos sun). Un corp elementar descoperit în spectrul solar și prezent pe pământ în unele minerale rare; este inclus în aer în cantităţi neglijabile. Dicționar de cuvinte străine incluse în limba rusă. Chudinov A.N... Dicționar de cuvinte străine ale limbii ruse
- (simbol He), un element gazos nemetalic, GAZ NOBIL, descoperit în 1868. Obținut pentru prima dată din mineralul klevita (un tip de uranit) în 1895. În prezent, principala sa sursă este gazul natural. Conținut și în... ... Dicționar enciclopedic științific și tehnic
Eu, soț. , vechi Eliy, I. Raport: Gelievich, Gelievna Derivate: Gelya (Gela); Elya.Origine: (Din grecescul hēlios sun.)Ziua numelui: 27 iulie Dicționar de nume de persoane. Heliu Vezi Ellium. Ziua Îngerului. Referinţă... Dicționar de nume de persoane
HELIU- chimic. element, simbol El (lat. Heliu), la. n. 2, la. m. 4,002, se referă la gaze inerte (nobile); incolor si inodor, densitate 0,178 kg/m3. În condiții obișnuite, gazul este un gaz monoatomic, al cărui atom este format dintr-un nucleu și doi electroni; este format... Marea Enciclopedie Politehnică
- (Heliu), He, element chimic din grupa VIII a tabelului periodic, număr atomic 2, masă atomică 4,002602; aparține gazelor nobile; substanța cu punctul de fierbere cel mai scăzut (bp 268,93°C), singura care nu se întărește la presiune normală;... ... Enciclopedie modernă
Chim. element al optulea gr. tabel periodic, numărul de serie 2; gaz inert cu at. V. 4.003. Este format din doi izotopi stabili He4 și He3. Soder. Ele nu sunt constante și depind de sursa de formare, dar predomină întotdeauna izotopul greu. ÎN… … Enciclopedie geologică
Heliu- (Heliu), He, element chimic din grupa VIII a tabelului periodic, număr atomic 2, masă atomică 4,002602; aparține gazelor nobile; cea mai scăzută substanță de fierbere (punct de fierbere 268,93°C), singura care nu se întărește la presiune normală;... ... Dicţionar Enciclopedic Ilustrat
Sunny Dictionary of Russian sinonime. heliu substantiv, număr de sinonime: 4 gaz (55) nume (1104) ... Dicţionar de sinonime
HELIUM, eu, soț. Un element chimic, un gaz inert, incolor și inodor, cel mai ușor gaz după hidrogen. | adj. heliu, oh, oh. Dicţionar Ozhegova. SI. Ozhegov, N.Yu. Şvedova. 1949 1992... Dicționarul explicativ al lui Ozhegov
- Gazul (heliu) este incolor și inodor, inactiv din punct de vedere chimic, de 7,2 ori mai ușor decât aerul, nu arde. Se găsește în cantități foarte mici în atmosferă (1/2000%). Datorită ușurinței și neinflamabilității, este folosit în principal pentru umplerea aeronavelor ... Dicționar marin
Cărți
- Calul alb, Heliy Ryabov, 384 de pagini Heliy Ryabov este familiar cititorilor din serialul de televiziune Born of a Revolution, State Border, filmele One of Us, Theft, Favorite etc. . Categorie: