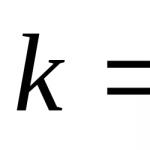Opt electroni pe exterior. Niveluri de energie externă: caracteristici structurale și rolul lor în interacțiunile dintre atomi
Ce se întâmplă cu atomii elementelor în timpul reacțiilor chimice? De ce depind proprietățile elementelor? Un răspuns poate fi dat la ambele întrebări: motivul constă în structura nivelului extern. În articolul nostru ne vom uita la electronica metalelor și a nemetalelor și vom afla relația dintre structura nivelului extern și. proprietățile elementelor.
Proprietăți speciale ale electronilor
Atunci când are loc o reacție chimică între moleculele a doi sau mai mulți reactivi, apar modificări în structura învelișurilor electronice ale atomilor, în timp ce nucleele acestora rămân neschimbate. În primul rând, să ne familiarizăm cu caracteristicile electronilor aflați la nivelurile atomului cel mai îndepărtat de nucleu. Particulele încărcate negativ sunt aranjate în straturi la o anumită distanță de nucleu și unele de altele. Spațiul din jurul nucleului unde electronii sunt cel mai probabil să se găsească se numește orbital de electroni. Aproximativ 90% din norul de electroni încărcat negativ este condensat în el. Electronul însuși dintr-un atom prezintă proprietatea dualității se poate comporta simultan atât ca o particulă, cât și ca o undă.
Reguli pentru umplerea învelișului de electroni a unui atom
Numărul de niveluri de energie la care se află particulele este egal cu numărul perioadei în care se află elementul. Ce indică compoziția electronică? S-a dovedit că la nivelul de energie externă pentru elementele s și p principalele subgrupe de perioade mici și mari corespund numărului grupului. De exemplu, atomii de litiu din primul grup, care au două straturi, au un electron în învelișul exterior. Atomii de sulf conțin șase electroni în ultimul nivel de energie, deoarece elementul este situat în subgrupul principal a șasea grupă etc. Dacă vorbim despre elementele d, atunci pentru ele există următoarea regulă: numărul de particule negative externe este 1 (pentru crom și cupru) sau 2. Acest lucru se explică prin faptul că, pe măsură ce sarcina a nucleelor atomilor crește, mai întâi subnivelul d intern este umplut, iar nivelurile de energie externă rămân neschimbate.
De ce se schimbă proprietățile elementelor perioadelor mici?
Perioadele 1, 2, 3 și 7 sunt considerate mici. Schimbarea lină a proprietăților elementelor pe măsură ce crește sarcinile nucleare, variind de la metale active la gaze inerte, se explică printr-o creștere treptată a numărului de electroni la nivel extern. Primele elemente din astfel de perioade sunt cele ai căror atomi au doar unul sau doi electroni care pot fi îndepărtați cu ușurință din nucleu. În acest caz, se formează un ion metalic încărcat pozitiv.

Elementele amfotere, cum ar fi aluminiul sau zincul, își umple nivelurile exterioare de energie o cantitate mică electroni (1 pentru zinc, 3 pentru aluminiu). În funcție de condițiile reacției chimice, ele pot prezenta atât proprietățile metalelor, cât și ale nemetalelor. Elementele nemetalice de perioade mici conțin de la 4 până la 7 particule negative pe învelișurile exterioare ale atomilor lor și le completează la octet, atrăgând electroni de la alți atomi. De exemplu, nemetalul cu cea mai mare electronegativitate, fluorul, are 7 electroni în ultimul strat și ia întotdeauna un electron nu numai din metale, ci și din elementele nemetalice active: oxigen, clor, azot. Perioadele mici, precum cele mari, se termină cu gaze inerte, ale căror molecule monoatomice au completat complet nivelurile exterioare de energie de până la 8 electroni.
Caracteristici ale structurii atomilor de perioade lungi
Rândurile pare ale perioadelor 4, 5 și 6 constau din elemente ale căror învelișuri exterioare găzduiesc doar unul sau doi electroni. După cum am spus mai devreme, ele umplu subnivelurile d sau f ale penultimului strat cu electroni. De obicei, acestea sunt metale tipice. Fizice și proprietăți chimice se schimbă foarte încet. Rândurile impare conțin elemente ale căror niveluri exterioare de energie sunt umplute cu electroni conform următoarea diagramă: metale - element amfoter - nemetale - gaz inert. Am observat deja manifestarea ei în toate perioadele mici. De exemplu, în rândul impar al perioadei a 4-a, cuprul este un metal, zincul este amfoter, apoi de la galiu la brom există o creștere a proprietăților nemetalice. Perioada se termină cu criptonul, ai cărui atomi au o înveliș de electroni complet completat.

Cum se explică împărțirea elementelor în grupuri?
Fiecare grup - și sunt opt dintre ele în forma scurtă a tabelului - este, de asemenea, împărțit în subgrupe, numite principale și secundare. Această clasificare reflectă pozițiile diferite ale electronilor pe nivelul energetic extern al atomilor elementelor. S-a dovedit că pentru elementele principalelor subgrupe, de exemplu, litiu, sodiu, potasiu, rubidiu și cesiu, ultimul electron este situat la subnivelul s. Elementele grupului 7 din subgrupa principală (halogeni) își umplu subnivelul p cu particule negative.
Pentru reprezentanții subgrupurilor laterale, cum ar fi cromul, umplerea subnivelului d cu electroni va fi tipică. Iar pentru elementele incluse în familii, acumularea de sarcini negative are loc la subnivelul f al penultimului nivel energetic. În plus, numărul grupului, de regulă, coincide cu numărul de electroni capabili să formeze legături chimice.

În articolul nostru, am aflat ce structură au nivelurile de energie externă ale atomilor elementelor chimice și am determinat rolul acestora în interacțiunile interatomice.
E.N.Frenkel
Tutorial de chimie
Un manual pentru cei care nu știu, dar vor să învețe și să înțeleagă chimia
Partea I. Elemente de chimie generală
(primul nivel de dificultate)
Continuare. Vezi începutul în Nr. 13, 18, 23/2007
Capitolul 3. Informații de bază despre structura atomului.
Legea periodică a lui D.I.Mendeleev
Amintiți-vă ce este un atom, din ce este alcătuit un atom, dacă un atom se modifică în reacțiile chimice.
Un atom este o particulă neutră din punct de vedere electric constând dintr-un nucleu încărcat pozitiv și electroni încărcați negativ.
Numărul de electroni se poate modifica în timpul proceselor chimice, dar sarcina nucleară rămâne mereu aceeași. Cunoscând distribuția electronilor într-un atom (structura atomică), se pot prezice multe proprietăți ale unui atom dat, precum și proprietățile simple și substanțe complexe, din care este inclus.
Structura atomului, adică Compoziția nucleului și distribuția electronilor în jurul nucleului pot fi ușor determinate de poziția elementului în tabelul periodic.
În sistemul periodic al lui D.I Mendeleev, elementele chimice sunt aranjate într-o anumită secvență. Această secvență este strâns legată de structura atomică a acestor elemente. Fiecare element chimic din sistem este atribuit număr de serie, în plus, puteți specifica numărul perioadei, numărul grupului și tipul de subgrup pentru aceasta.
Sponsorul publicării articolului este magazinul online „Megamech”. În magazin veți găsi produse din blană pentru toate gusturile - jachete, veste și haine de blană din vulpe, nutria, iepure, nurcă, vulpe argintie, vulpe arctică. De asemenea, compania vă oferă să achiziționați produse din blană de lux și să utilizați servicii de croitorie la comandă. Produse de blană en-gros și cu amănuntul - de la categoria buget la clasa de lux, reduceri de până la 50%, 1 an garanție, livrare în toată Ucraina, Rusia, CSI și țările UE, ridicare de la showroom-ul din Krivoy Rog, mărfuri de la producători ucraineni de top, Rusia, Turcia și China. Puteți vizualiza catalogul de produse, prețuri, contacte și puteți obține sfaturi pe site-ul, care se află la: „megameh.com”.
Cunoscând „adresa” exactă a unui element chimic - grup, subgrup și număr de perioadă, puteți determina fără ambiguitate structura atomului său.
Perioadă este un rând orizontal de elemente chimice. Sistemul periodic modern are șapte perioade. Primele trei perioade sunt mic, pentru că conțin 2 sau 8 elemente:
1a perioadă – H, He – 2 elemente;
Perioada a 2-a – Li… Ne – 8 elemente;
Perioada a 3-a – Na...Ar – 8 elemente.
Alte perioade - mare. Fiecare dintre ele conține 2-3 rânduri de elemente:
A 4-a perioadă (2 rânduri) – K...Kr – 18 elemente;
A 6-a perioadă (3 rânduri) – Cs ... Rn – 32 elemente. Această perioadă include o serie de lantanide.
Grup– un rând vertical de elemente chimice. Sunt opt grupe în total. Fiecare grup este format din două subgrupe: subgrupul principalŞi subgrup lateral. De exemplu:
Subgrupul principal este format din elemente chimice de perioade scurte (de exemplu, N, P) și perioade mari (de exemplu, As, Sb, Bi).
Un subgrup lateral este format din elemente chimice de numai perioade lungi (de exemplu, V, Nb,
Ta).
Din punct de vedere vizual, aceste subgrupuri sunt ușor de distins.
Subgrupul principal este „înalt”, începe din prima sau a doua perioadă. Subgrupul secundar este „scăzut”, începe din a 4-a perioadă. Deci toată lumea element chimic
Sistemul periodic are propria sa adresă: perioadă, grup, subgrup, număr de serie.
De exemplu, vanadiul V este un element chimic al perioadei a 4-a, grupul V, subgrupul secundar, numărul de serie 23. Sarcina 3.1.
Indicați perioada, grupa și subgrupa pentru elementele chimice cu numerele de serie 8, 26, 31, 35, 54. Sarcina 3.2.
Indicați numărul de serie și denumirea elementului chimic, dacă se știe că se află:
a) în perioada a IV-a, grupa VI, subgrupa secundară;
Cum pot fi legate informațiile despre poziția unui element în tabelul periodic cu structura atomului său?
Un atom este format dintr-un nucleu (au sarcină pozitivă) și electroni (au sarcină negativă). În general, atomul este neutru din punct de vedere electric.
Pozitiv sarcina nucleara atomica egal cu numărul de serie al elementului chimic.
Nucleul unui atom este o particulă complexă. Aproape toată masa unui atom este concentrată în nucleu. Deoarece un element chimic este o colecție de atomi cu aceeași sarcină nucleară, lângă simbolul elementului sunt indicate următoarele coordonate:

Din aceste date se poate determina compoziția nucleului.
Nucleul este format din protoni și neutroni. Proton p are o masă de 1 (1,0073 amu) și o sarcină de +1. Neutroni
n nu are sarcină (neutră), iar masa sa este aproximativ egală cu masa unui proton (1,0087 a.u.m.). Sarcina nucleului este determinată de protoni. În plus numărul de protoni este egal(dupa marime) sarcina nucleului atomic.
, adică număr de serie Numărul de neutroni N determinată de diferența dintre cantități: „masa miezului” Oși „număr de serie”
număr de serie = N – O = 27 –13 = 14are o masă de 1 (1,0073 amu) și o sarcină de +1.,

Z. Deci, pentru un atom de aluminiu:
Sarcina 3.3.
Determinați compoziția nucleelor atomice dacă elementul chimic este în:
a) perioada a 3-a, grupa VII, subgrupa principală;
b) perioada a IV-a, grupa IV, subgrupul secundar;
c) perioada a 5-a, grupa I, subgrupa principală.
Atenţie! La determinarea numărului de masă al nucleului unui atom, este necesar să se rotunjească masa atomică indicată în tabelul periodic. Acest lucru se face deoarece masele protonului și neutronului sunt practic întregi, iar masa electronilor poate fi neglijată. Să determinăm care dintre nucleele de mai jos aparțin aceluiași element chimic: + 20are o masă de 1 (1,0073 amu) și o sarcină de +1.),
A (20 Să determinăm care dintre nucleele de mai jos aparțin aceluiași element chimic: + 20are o masă de 1 (1,0073 amu) și o sarcină de +1.),
r Să determinăm care dintre nucleele de mai jos aparțin aceluiași element chimic: + 19are o masă de 1 (1,0073 amu) și o sarcină de +1.).
B (19
V (20
Nucleii A și B aparțin atomilor aceluiași element chimic, deoarece conțin același număr de protoni, adică sarcinile acestor nuclee sunt aceleași. Cercetările arată că masa unui atom nu afectează semnificativ proprietățile sale chimice. Izotopii sunt atomi ai aceluiași element chimic (același număr de protoni) care diferă ca masă (număr diferit de neutroni). Izotopii și lor compuși chimici diferă unul de altul în
Să revenim la descrierea structurii atomului. După cum se știe, nucleul unui atom nu se modifică în procesele chimice. Ce se schimbă? Numărul total de electroni dintr-un atom și distribuția electronilor sunt variabile. General
![]()
numărul de electroni dintr-un atom neutru
Nu este dificil de determinat - este egal cu numărul de serie, adică. sarcina nucleului atomic:
Electronii au o sarcină negativă de –1, iar masa lor este neglijabilă: 1/1840 din masa unui proton.

Electronii încărcați negativ se resping reciproc și se află la distanțe diferite de nucleu. În același timp electronii care au cantități aproximativ egale de energie sunt localizați la distanțe aproximativ egale de nucleu și formează un nivel de energie.
Numărul de niveluri de energie dintr-un atom este egal cu numărul perioadei în care se află elementul chimic. Nivelurile de energie sunt desemnate în mod convențional după cum urmează (de exemplu, pentru Al):
Sarcina 3.4.
Determinați numărul de niveluri de energie din atomii de oxigen, magneziu, calciu și plumb.
Fiecare nivel de energie poate conține un număr limitat de electroni:
Primul nu are mai mult de doi electroni;
Al doilea nu are mai mult de opt electroni; Al treilea nu are mai mult de optsprezece electroni. Aceste numere arată că, de exemplu, al doilea nivel de energie poate avea 2, 5 sau 7 electroni, dar nu poate avea 9 sau 12 electroni. Este important să știți că, indiferent de nivelul de energie numărul pornit nivel extern
(ultimul) nu poate avea mai mult de opt electroni. Nivelul exterior de energie de opt electroni este cel mai stabil și se numește complet. Astfel de niveluri de energie se găsesc în elementele cele mai inactive - gazele nobile.
Cum se determină numărul de electroni la nivelul exterior al atomilor rămași? Există o regulă simplă pentru asta:
numărul de electroni exteriori
este egal cu:
Pentru elementele subgrupelor principale - numărul grupului; Pentru elementele subgrupurilor laterale nu poate fi mai mult de două.
De exemplu (Fig. 5): Sarcina 3.5.
Indicați numărul de electroni exteriori pentru elementele chimice cu numere atomice 15, 25, 30, 53. Sarcina 3.6. Găsiți elemente chimice în tabelul periodic ai căror atomi au un nivel exterior complet. Este foarte important să se determine corect numărul de electroni exteriori, deoarece cu ele sunt asociate cele mai importante proprietăţi ale atomului. Deci, în reactii chimice
Se numesc elemente chimice ai căror atomi sunt capabili doar să doneze electroni metale.
Evident, ar trebui să existe puțini electroni la nivelul exterior al unui atom de metal: 1, 2, 3. Dacă există mulți electroni în nivelul de energie exterior al unui atom, atunci astfel de atomi tind să accepte electroni până când nivelul de energie exterior este finalizat, adică până la opt electroni. Astfel de elemente sunt numite.
nemetale
Întrebare. Elementele chimice ale subgrupurilor secundare sunt metale sau nemetale? De ce?
Răspuns: Metalele și nemetalele principalelor subgrupe din tabelul periodic sunt separate printr-o linie care poate fi trasată de la bor la astatin. Deasupra acestei linii (și pe linie) sunt nemetale, sub - metale. Toate elementele subgrupurilor laterale apar sub această linie. Sarcina 3.7.
Determinați dacă următoarele sunt metale sau nemetale: fosfor, vanadiu, cobalt, seleniu, bismut. Utilizați poziția elementului în tabelul periodic al elementelor chimice și numărul de electroni din învelișul exterior.
Pentru a compila distribuția electronilor pe nivelurile și subnivelurile rămase, ar trebui să utilizați următorul algoritm.
1. Determinați numărul total de electroni dintr-un atom (după numărul atomic).
2. Determinați numărul de niveluri de energie (după numărul perioadei).
3. Determinați numărul de electroni externi (după tipul de subgrup și numărul de grup).
4. Indicați numărul de electroni la toate nivelurile, cu excepția penultimului.

De exemplu, conform paragrafelor 1-4 pentru atomul de mangan se determină: Este foarte important să se determine corect numărul de electroni exteriori, deoarece cu ele sunt asociate cele mai importante proprietăţi ale atomului. Deci, în Total 25 ; distribuit (2 + 8 + 2) = 12 e ; distribuit (2 + 8 + 2) = 12.
;

Aceasta înseamnă că la al treilea nivel există: 25 – 12 = 13 Am obținut distribuția electronilor în atomul de mangan:
Sarcina 3.8. Elaborați algoritmul întocmind diagrame ale structurii atomilor pentru elementele nr. 16, 26, 33, 37. Indicați dacă sunt metale sau nemetale. Explicați răspunsul dvs. La compilarea diagramelor de mai sus ale structurii unui atom, nu am ținut cont de faptul că electronii dintr-un atom ocupă nu numai niveluri, ci și anumite subniveluri, Proton, fiecare nivel. Tipurile de subniveluri sunt indicate prin litere latine:.
s d
subniveluri Numărul de subniveluri posibile este egal cu numărul nivelului. subniveluri Primul nivel este format dintr-unul Să determinăm care dintre nucleele de mai jos aparțin aceluiași element chimic:-subnivel. Al doilea nivel este format din două subnivele - subniveluri, Proton Primul nivel este format dintr-unul fiecare nivel. Tipurile de subniveluri sunt indicate prin litere latine:.
Şi
. Al treilea nivel - din trei subniveluri -
Fiecare subnivel poate conține un număr strict limitat de electroni:
la subnivelul s – nu mai mult de 2e;
la subnivelul p - nu mai mult de 6e; subniveluriProtonfiecare nivel. Tipurile de subniveluri sunt indicate prin litere latine:.
la subnivelul d – nu mai mult de 10e. Să determinăm care dintre nucleele de mai jos aparțin aceluiași element chimic: Subnivelurile de același nivel sunt completate într-o ordine strict definită: subniveluri-subnivelul unui nivel energetic dat etc. Pe baza acestei reguli, nu este dificil să creați configurația electronică a atomului de mangan:

În general configurația electronică a unui atom manganul se scrie astfel:
25 Mn 1 subniveluri 2 2subniveluri 2 2Proton 6 3subniveluri 2 3Proton 6 3fiecare nivel. Tipurile de subniveluri sunt indicate prin litere latine: 5 4subniveluri 2 .
Sarcina 3.9. Alcătuiți configurații electronice ale atomilor pentru elementele chimice nr. 16, 26, 33, 37.
De ce este necesar să se creeze configurații electronice ale atomilor? Pentru a determina proprietăţile acestor elemente chimice. Trebuie amintit că în procese chimice participa doar.
electroni de valență
Electronii de valență se află la nivelul energetic exterior și sunt incompleti
d-subnivelul nivelului pre-extern.

Să determinăm numărul de electroni de valență pentru mangan: fiecare nivel. Tipurile de subniveluri sunt indicate prin litere latine: 5 4subniveluri 2 .
sau prescurtat: Mn... 3
Ce se poate determina prin formula pentru configurația electronică a unui atom?
1. Ce element este acesta - metal sau nemetal?
Manganul este un metal pentru că nivelul exterior (al patrulea) conține doi electroni.
2. Ce proces este caracteristic metalului?
Atomii de mangan renunță întotdeauna la electroni în reacții.
3. La ce electroni și la câți va renunța atomul de mangan? fiecare nivel. Tipurile de subniveluri sunt indicate prin litere latine:În reacții, atomul de mangan renunță la doi electroni exteriori (aceștia sunt cei mai îndepărtați de nucleu și sunt cel mai slab atrași de acesta), precum și cinci electroni exteriori
-electroni.
Numărul total de electroni de valență este de șapte (2 + 5). În acest caz, opt electroni vor rămâne la al treilea nivel al atomului, adică. se formează un nivel extern completat..
Toate aceste argumente și concluzii pot fi reflectate folosind o diagramă (Fig. 6):
Sarcinile convenționale rezultate ale atomului sunt numite
stări de oxidare
![]()
Având în vedere structura atomului, în mod similar se poate demonstra că stările tipice de oxidare pentru oxigen sunt –2, iar pentru hidrogen +1.
Întrebare. Cu ce element chimic poate forma manganul compuși, ținând cont de stările sale de oxidare obținute mai sus?
Ca nemetal, un atom de Te poate accepta 2 electroni înainte de a finaliza nivelul exterior și poate renunța la cei 6 electroni „în plus”:

Sarcina 3.10. Desenați configurațiile electronice ale atomilor de Na, Rb, Cl, I, Si, Sn. Determinați proprietățile acestor elemente chimice, formulele celor mai simpli compuși ai lor (cu oxigen și hidrogen).
Concluzii practice
1. Doar electronii de valență, care pot fi doar în ultimele două niveluri, participă la reacțiile chimice.
2. Atomii de metal nu pot dona decât electroni de valență (toți sau mai mulți), acceptând stări de oxidare pozitive.
3. Atomii nemetalici pot accepta electroni (până la opt cei lipsă), în timp ce dobândesc stări negative de oxidare, și renunță la electroni de valență (toți sau mai mulți), în timp ce aceștia dobândesc stări de oxidare pozitive.
Să comparăm acum proprietățile elementelor chimice ale unui subgrup, de exemplu sodiu și rubidiu:
Na...3 subniveluri 1 și Rb...5 subniveluri 1 .
Ce au în comun structurile atomice ale acestor elemente? La nivelul exterior al fiecărui atom, un electron este metalele active. Activitatea metalelor
este asociată cu capacitatea de a renunța la electroni: cu cât un atom renunță mai ușor la electroni, cu atât proprietățile sale metalice sunt mai pronunțate.
Ce reține electronii într-un atom? Atracția lor spre miez. Cu cât electronii sunt mai aproape de nucleu, cu atât sunt mai puternici atrași de nucleul atomului, cu atât este mai dificil să îi „smulgeți”.
Pe baza acestui lucru, vom răspunde la întrebarea: care element - Na sau Rb - renunță mai ușor la electronul exterior? Care element este metalul mai activ? Evident, rubidiu, pentru că electronii săi de valență sunt mai departe de nucleu (și ținuți mai puțin strâns de nucleu). Concluzie.În principalele subgrupe, de sus în jos, proprietățile metalice cresc
, pentru că subniveluri 2 3Proton Raza atomului crește, iar electronii de valență sunt mai puțin atrași de nucleu. subniveluri 2 5Proton 5 .
Să comparăm proprietățile elementelor chimice din grupa VIIa: Cl...3
5 si eu...5
Ambele elemente chimice sunt nemetale, deoarece Un electron lipsește pentru a finaliza nivelul exterior. Acești atomi vor atrage în mod activ electronul lipsă. Mai mult, cu cât un atom nemetalic atrage mai puternic electronul lipsă, cu atât mai mult se manifestă proprietățile sale nemetalice (abilitatea de a accepta electroni).
RĂSPUNS: Evident, cu clor, pentru că electronii săi de valență se află mai aproape de nucleu.
Pe baza acestui lucru, vom răspunde la întrebarea: care element - Na sau Rb - renunță mai ușor la electronul exterior? Care element este metalul mai activ? Evident, rubidiu, pentru că electronii săi de valență sunt mai departe de nucleu (și ținuți mai puțin strâns de nucleu). Activitatea nemetalelor în subgrupe scade de sus în jos, pentru că Raza atomului crește și devine din ce în ce mai dificil pentru nucleu să atragă electronii lipsă.
Să comparăm proprietățile siliciului și staniului: Si...3 subniveluri 2 3Proton 2 și Sn...5 subniveluri 2 5Proton 2 .
Nivelul exterior al ambilor atomi are patru electroni. Cu toate acestea, aceste elemente din tabelul periodic se află pe părțile opuse ale liniei care leagă borul și astatinul.
Prin urmare, siliciul, al cărui simbol este situat deasupra liniei B-At, are proprietăți nemetalice mai pronunțate. Dimpotrivă, staniul, al cărui simbol este sub linia B-At, prezintă proprietăți metalice mai puternice. Acest lucru se explică prin faptul că în atomul de staniu sunt îndepărtați patru electroni de valență din nucleu. Prin urmare, adăugarea celor patru electroni lipsă este dificilă. În același timp, eliberarea electronilor de la al cincilea nivel de energie are loc destul de ușor. Pentru siliciu, ambele procese sunt posibile, predominând primul (acceptarea electronilor). Concluzii pentru capitolul 3.
Cu cât sunt mai puțini electroni exteriori într-un atom și cu cât sunt mai departe de nucleu, cu atât proprietățile metalice sunt mai puternice.
Cu cât sunt mai mulți electroni exteriori într-un atom și cu cât sunt mai aproape de nucleu, cu atât proprietățile nemetalice sunt mai pronunțate.
Pe baza concluziilor formulate în acest capitol, o „caracteristică” poate fi compilată pentru orice element chimic al tabelului periodic.
Algoritm de descriere a proprietății
element chimic prin poziția sa
în tabelul periodic
1. Întocmește o diagramă a structurii unui atom, adică.
determinați compoziția nucleului și distribuția electronilor de-a lungul nivelurilor și subnivelurilor de energie:
Determinați numărul total de protoni, electroni și neutroni dintr-un atom (după numărul atomic și masa atomică relativă);
Determinați numărul de niveluri de energie (după numărul perioadei);
Determinați numărul de electroni externi (după tipul de subgrup și numărul de grup);
Indicați numărul de electroni în toate nivelurile de energie, cu excepția penultimului;
2. Determinați numărul de electroni de valență.
3. Stabiliți ce proprietăți - metal sau nemetal - sunt mai pronunțate într-un anumit element chimic.
4. Determinați numărul de electroni dați (primiți). 5. Determinați cele mai înalte și cele mai scăzute stări de oxidare ale unui element chimic. 6. Compune pentru aceste stări de oxidare
formule chimice
cei mai simpli compuși cu oxigen și hidrogen.
Sarcina 3.11. Folosind schema de mai sus, creați descrieri ale atomilor de sulf, seleniu, calciu și stronțiu și proprietățile acestor elemente chimice.
Ce proprietăți generale prezintă oxizii și hidroxizii lor?
Dacă ați finalizat exercițiile 3.10 și 3.11, atunci este ușor de observat că nu numai atomii elementelor aceluiași subgrup, ci și compușii lor au proprietăți comune și o compoziție similară.Legea periodică a lui D.I.Mendeleev:
proprietățile elementelor chimice, precum și proprietățile substanțelor simple și complexe formate de acestea, depind periodic de sarcina nucleelor atomilor lor. Sensul fizic al legii periodice:
proprietățile elementelor chimice se repetă periodic deoarece configurațiile electronilor de valență (distribuția electronilor de la nivelul exterior și penultimul) se repetă periodic.
Astfel, elementele chimice din aceeași subgrupă au aceeași distribuție a electronilor de valență și, prin urmare, proprietăți similare. De exemplu, elementele chimice din grupa 5 au cinci electroni de valență. În același timp, în atomi chimici elementele principalelor subgrupe – toți electronii de valență se află la nivelul exterior: ... 2 ns n.p. are o masă de 1 (1,0073 amu) și o sarcină de +1. 3 unde
– numărul perioadei. La atomi elemente ale subgrupurilor laterale fiecare nivel. Tipurile de subniveluri sunt indicate prin litere latine: Există doar 1 sau 2 electroni la nivelul exterior, restul sunt înăuntru are o masă de 1 (1,0073 amu) și o sarcină de +1. – 1)fiecare nivel. Tipurile de subniveluri sunt indicate prin litere latine: 3 – toți electronii de valență se află la nivelul exterior: ...-subnivelul nivelului pre-extern: ... ( are o masă de 1 (1,0073 amu) și o sarcină de +1. 2 unde
– numărul perioadei. Sarcina 3.12.
Compuneți scurte formule electronice pentru atomii elementelor chimice nr. 35 și 42 și apoi compuneți distribuția electronilor în acești atomi conform algoritmului. Asigurați-vă că predicția dvs. se împlinește.
Exerciții pentru capitolul 3
2. 1. Formulați definiții ale conceptelor „perioadă”, „grup”, „subgrup”. Ce au în comun elementele chimice care alcătuiesc: a) perioada? b) grup; c) subgrup?
3. Ce sunt izotopii? Ce proprietăți - fizice sau chimice - au izotopii aceleași proprietăți? De ce?
4. Formulați legea periodică a lui D.I. Mendeleev. Explicați semnificația sa fizică și ilustrați cu exemple.
5. Care sunt proprietățile metalice ale elementelor chimice? Cum se schimbă în cadrul unui grup și pe o perioadă? De ce?
6. Care sunt proprietățile nemetalice ale elementelor chimice? Cum se schimbă în cadrul unui grup și pe o perioadă? De ce?
7. Scrieți formule electronice scurte pentru elementele chimice nr. 43, 51, 38. Confirmați-vă ipotezele descriind structura atomilor acestor elemente folosind algoritmul de mai sus.
Specificați proprietățile acestor elemente. subniveluri După formule electronice scurte
a) ...4 fiecare nivel. Tipurile de subniveluri sunt indicate prin litere latine: 1 5subniveluri 2 ;
2 4p 1 ; fiecare nivel. Tipurile de subniveluri sunt indicate prin litere latine: b) ...4
determinați poziția elementelor chimice corespunzătoare în tabelul periodic al lui D.I. Mendeleev. Numiți aceste elemente chimice.
Confirmați-vă ipotezele prin descrierea structurii atomilor acestor elemente chimice conform algoritmului. Indicați proprietățile acestor elemente chimice.
De continuat
Malyugina 14. Niveluri de energie externă și internă. Completitudinea nivelului de energie.
Să ne amintim pe scurt ceea ce știm deja despre structura învelișului de electroni a atomilor:
ü numărul de niveluri energetice ale unui atom = numărul perioadei în care se află elementul;
ü capacitatea maximă a fiecărui nivel de energie se calculează folosind formula 2n2
ü învelișul energetic exterior nu poate conține mai mult de 2 electroni pentru elementele din prima perioadă și mai mult de 8 electroni pentru elementele din alte perioade
Să revenim încă o dată la analiza schemei de umplere a nivelurilor de energie în elemente de perioade mici:
Tabel 1. Niveluri de energie de umplere
pentru elemente de perioade mici | Numărul perioadei | Numărul de niveluri de energie = numărul perioadei | Simbolul elementului, numărul său de serie Cantitatea totala | electroni | Distribuția electronilor după niveluri de energie |
|
|
Numărul grupului )1 | +1 H +1 | |||||
|
N, 1e-; distribuit (2 + 8 + 2) = 12 + 2 ) 2 | +2 N | |||||
|
Nu, 2e- + 3 ) 2 ) 1 | + 3 Nu, 2e-Li | |||||
|
, 2e-, 1e- ) 2 )2 | + 4 Ve +4Fi2 , 2e-, | |||||
|
e- ) 2 )3 | +5 V +5 | |||||
|
B, 2e-, 3e- ) 2 )4 | +6 C +6 | |||||
|
număr de serie + 7 ) 2 ) 5 | + 7 număr de serieFi5 , 2e-, | |||||
|
C, 2e-, 4e- + 8 ) 2 ) 6 | + 8 C, 2e-, 4e-Fi6 , 2e-, | |||||
|
O + 9 ) 2 ) 7 | + 9 OFi7 , 2e-, | |||||
|
F + 10 ) 2 ) 8 | + 10 FFi8 Este foarte important să se determine corect numărul de electroni exteriori, deoarece cu ele sunt asociate cele mai importante proprietăţi ale atomului. Deci, în- | |||||
|
Ne + 11 ) 2 ) 8 )1 | +1 1 NeN / A , 2e-, 8e-, | |||||
|
1e- + 12 ) 2 ) 8 )2 | +1 2 1e-N / A 2 Mg | |||||
|
e- + 13 ) 2 ) 8 )3 | +1 3 e-N / A 3 Mg | |||||
|
Al + 14 ) 2 ) 8 )4 | +1 4 AlN / A 4 Mg | |||||
|
Si + 15 ) 2 ) 8 )5 | +1 5 SiN / A 5 Mg | |||||
|
P + 16 ) 2 ) 8 )6 | +1 5 SiN / A 6 Mg | |||||
|
S + 17 ) 2 ) 8 )7 | +1 7 SN / A 7 Mg | |||||
18 Cl |
Cl+ 18 ) 2 ) 8 )8 | +1 8 ClN / A 8 Mg |
Ar
Analizați Tabelul 1. Comparați numărul de electroni din ultimul nivel de energie și numărul grupului în care se află elementul chimic. Ai observat asta numărul de electroni din nivelul energetic exterior al atomilor coincide cu numărul grupului
!!! , în care se găsește elementul (cu excepția heliului)? Această regulă este adevărată numai pentru elemente principal
subgrupuri Fiecare perioadă a sistemului se termină cu un element inert (heliu He, neon Ne, argon Ar). Nivelul de energie exterior al acestor elemente conține numărul maxim posibil de electroni: heliu -2, elementele rămase - 8. Acestea sunt elemente din grupa VIII a subgrupului principal. Se numește un nivel de energie similar cu structura nivelului de energie al unui gaz inert finalizat . Acesta este un fel de limită de putere a nivelului de energie pentru fiecare element Tabel periodic
. Moleculele de substanțe simple - gaze inerte - constau dintr-un atom și se caracterizează prin inerție chimică, adică practic nu intră în reacții chimice. Pentru restul elementelor PSHE, nivelul de energie diferă de nivelul de energie al elementului inert se numesc astfel de niveluri. Atomii acestor elemente se străduiesc să completeze nivelul de energie exterior dând sau primind electroni.
Întrebări pentru autocontrol
1. Ce nivel de energie se numește extern?
2. Ce nivel de energie se numește intern?
3. Ce nivel de energie se numește complet?
4. Elementele din care grup și subgrup au un nivel de energie completat?
5. Care este numărul de electroni din nivelul energetic exterior al elementelor subgrupurilor principale?
6. Cum sunt similare elementele unui subgrup principal în structura nivelului electronic?
7. Câți electroni la nivelul exterior conțin elementele a) grupului IIA;
b) grupa IVA; c) VII A grup
Vizualizați răspunsul
1. Ultimul
2. Oricare, cu excepția ultimului
3. Cel care contine numarul maxim de electroni. Și, de asemenea, nivelul exterior, dacă conține 8 electroni pentru prima perioadă - 2 electroni.
4. Elemente din grupa VIIIA (elemente inerte)
5. Numărul grupului în care se află elementul
6. Toate elementele principalelor subgrupe la nivelul energiei exterioare conțin tot atâtea electroni cât numărul grupului
7. a) elementele grupei IIA au 2 electroni la nivelul exterior; b) elementele grupului IVA au 4 electroni; c) Elementele grupei VII A au 7 electroni.
Sarcini pentru soluție independentă
1. Identificați elementul pe baza următoarelor caracteristici: a) are 2 nivele electronice, pe cel exterior - 3 electroni; b) are 3 nivele electronice, pe cel exterior - 5 electroni. Scrieți distribuția electronilor de-a lungul nivelurilor de energie ale acestor atomi.
2. Care doi atomi au același număr de niveluri de energie umplute?
Vizualizați răspunsul:
1. a) Să stabilim „coordonatele” elementului chimic: 2 nivele electronice – perioada II; 3 electroni la nivelul exterior – grupa III A. Acesta este bor 5B. Diagrama distribuției electronilor pe niveluri de energie: 2e-, 3e-
b) perioada III, grupa VA, elementul fosfor 15P. Diagrama distribuției electronilor pe niveluri de energie: 2e-, 8e-, 5e-
2. d) sodiu şi clor.
Explicaţie: a) sodiu: +11 )2)8 )1 (umplut 2) ←→ hidrogen: +1)1
b) heliu: +2 )2 (umplut 1) ←→ hidrogen: hidrogen: +1)1
c) heliu: +2 )2 (umplut 1) ←→ neon: +10 )2)8 (umplut 2)
*G) sodiu: +11 )2)8 )1 (umplut 2) ←→ clor: +17 )2)8 )7 (complet 2)
4. Zece. Numărul de electroni = numărul atomic
5 c) arsen şi fosfor. Atomii aflați în același subgrup au același număr de electroni.
Explicatii:
a) sodiu și magneziu (în diferite grupe); b) calciu și zinc (în același grup, dar subgrupe diferite); * c) arsen și fosfor (într-unul, principal, subgrup) d) oxigen și fluor (în diferite grupuri).
7. d) numărul de electroni la nivelul exterior
8. b) numărul de niveluri energetice
9. a) litiu (situat în grupa IA din perioada II)
10. c) siliciu (grupa IVA, perioada III)
11. b) bor (2 nivele - IIperioadă, 3 electroni la nivelul exterior – IIIAgrup)
La nivelul energetic exterior al atomilor de fier, cobalt și nichel există câte 2 electroni. În subnivelul d al penultimului nivel energetic, fierul, cobaltul și nichelul au 6, 7 și, respectiv, 8 electroni. Stările de oxidare caracteristice ale metalelor din familia fierului sunt +2 și +3 (sunt cunoscuți compuși în care prezintă stări de oxidare de +1, +4 și +6, de exemplu, feratul de potasiu K 2 FeO 4, dar astfel de compuși sunt puţine şi departe). Pentru fier, compușii cu o stare de oxidare de (+3) sunt mai stabili, iar pentru nichel și cobalt - (+2). Prin urmare, Fe 2+ este un agent reducător destul de puternic, în timp ce Ni 2+ și Co 2+ nu posedă aceste proprietăți într-o măsură vizibilă, compușii de cobalt și nichel sunt destul de stabili în aer. În starea de oxidare +3, fierul, cobaltul și nichelul prezintă proprietăți oxidante, capacitatea de oxidare crește în seria Fe 3+ - Ni 3+ - Co 3+.
Proprietățile fierului, cobaltului și nichelului sunt foarte asemănătoare între ele (feromagneticitate, activitate catalitică, capacitatea de a forma ioni colorați, formare complexă). Cu toate acestea, există și diferențe între ele: fier, în ea proprietăți magnetice iese în evidență în triada, activitatea de reducere a fierului este mult mai mare decât cea a cobaltului și a nichelului, care, din punct de vedere al potențialelor lor de electrozi, sunt mai apropiate de staniu decât de fier.
Când sunt încălzite, metalele din familia fierului reacţionează puternic cu metaloizi, precum clorul, bromul, oxigenul, sulful etc. Fierul, cobaltul și nichelul pur din punct de vedere chimic nu se modifică sub influența aerului și a apei. Cu toate acestea, fierul obișnuit conține diverse impurități, astfel încât se corodează în aerul umed. Stratul de rugină rezultat este fragil și poros, nu împiedică contactul metalului mediuși nu îl protejează de oxidarea ulterioară. La temperaturi ridicate, fierul interacționează cu apa, înlocuind hidrogenul din aceasta. Fierul se dizolvă ușor în acizi diluați; cobaltul și nichelul sunt mult mai dificile.
La o concentrație mare de acizi la rece, fierul este pasivizat, devenind acoperit cu o peliculă subțire de oxizi. Oxizii tuturor celor trei metale (FeO, CoO, NiO) sunt insolubili în apă. Hidrații lor sunt obținuți prin acțiunea alcaline asupra sărurilor solubile. Hidrații de oxizi prezintă proprietăți de bază. Hidroxidul de Fe(OH)2, interacționând cu oxigenul aerului și apa, oxidează rapid:
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3.
Oxidarea ionilor de Co 2+ și în special de Ni 2+ este puțin mai dificilă. Dintre oxizii și hidroxizii de Fe, Co, Ni, numai Fe 2 O 3 și Fe(OH) 3 sunt amfoteri, cu predominanța proprietăților de bază. Oxizii și hidroxizii de cobalt și nichel sunt agenți oxidanți puternici; atunci când interacționează cu acizii, aceștia se reduc la săruri ale metalelor bivalente:
Co203 + 6HC1 = 2CoC12 + CI2 + 3H20;
4Ni(OH) 3 + 4H 2 SO 4 = 4NiSO 4 + O 2 + 10H 2 O
Compușii Fe 3+ sunt agenți oxidanți slabi și, sub acțiunea agenților reducători, se transformă în derivați Fe 2+:
H2S + Fe2(SO4)3 = S + 2FeSO4 + H2SO4
Mulți ioni simpli și complecși ai elementelor fier, cobalt și nichel sunt colorați. Astfel, ionii de Co 2+ hidratați sunt roz, Ni 2+ sunt verzi, Fe 3+ în soluție apoasă datorită hidrolizei are o culoare galben-maronie.
Un atom este o particulă neutră din punct de vedere electric, constând dintr-un nucleu încărcat pozitiv și un înveliș de electroni încărcat negativ. Nucleul este situat în centrul atomului și este format din protoni încărcați pozitiv și neutroni neîncărcați ținuți împreună de forțele nucleare. Structura nucleară a atomului a fost dovedită experimental în 1911 de către fizicianul englez E. Rutherford.
Numărul de protoni determină sarcina pozitivă a nucleului și este egal cu numărul atomic al elementului. Numărul de neutroni este calculat ca diferență dintre masa atomică și numărul atomic al elementului. Elementele care au aceeași sarcină nucleară (același număr de protoni) dar masă atomică diferită (număr diferit de neutroni) se numesc izotopi. Masa unui atom este concentrată în principal în nucleu, deoarece masa neglijabilă a electronilor poate fi neglijată. Masa atomică este egală cu suma maselor tuturor protonilor și tuturor neutronilor din nucleu.
Un element chimic este un tip de atom cu aceeași sarcină nucleară. În prezent, sunt cunoscute 118 elemente chimice diferite.
Toți electronii unui atom formează învelișul său de electroni. Învelișul de electroni are o sarcină negativă egală cu numărul total de electroni. Numărul de electroni din învelișul unui atom coincide cu numărul de protoni din nucleu și este egal cu numărul atomic al elementului. Electronii din înveliș sunt distribuiți între straturile electronice în funcție de rezervele de energie (electronii cu valori energetice similare formează un singur strat de electroni): electronii cu energie mai mică sunt mai aproape de nucleu, electronii cu mai multa energie sunt mai departe de miez. Numărul de straturi electronice (niveluri de energie) coincide cu numărul perioadei în care se află elementul chimic.
Există niveluri de energie finalizate și incomplete. Un nivel este considerat complet dacă conține numărul maxim posibil de electroni (primul nivel - 2 electroni, al doilea nivel - 8 electroni, al treilea nivel - 18 electroni, al patrulea nivel - 32 electroni etc.). Un nivel incomplet conține mai puțini electroni.
Nivelul cel mai îndepărtat de nucleul atomului se numește extern. Electronii aflați în nivelul de energie exterior se numesc electroni exteriori (de valență). Numărul de electroni din nivelul energetic exterior coincide cu numărul grupului în care se află elementul chimic. Nivelul exterior este considerat complet dacă conține 8 electroni. Atomii elementelor din grupa 8A (gaze inerte heliu, neon, kripton, xenon, radon) au un nivel de energie extern complet.
Regiunea spațiului din jurul nucleului unui atom în care este cel mai probabil să se găsească un electron se numește orbital de electroni. Orbitalii diferă ca nivel de energie și formă. Pe baza formei lor, există orbitali s (sferă), orbitali p (figura opt tridimensională), orbitali d și orbitalii f. Fiecare nivel de energie are propriul său set de orbitali: la primul nivel de energie - un orbital s, la al doilea nivel de energie - unul s- și trei orbitali p, la al treilea nivel de energie - un s-, trei p-, cinci d-orbitali, la al patrulea nivel de energie există un s-, trei p-, cinci d-orbitali și șapte f-orbitali. Fiecare orbital poate găzdui maxim doi electroni.
Distribuția electronilor între orbiti este reflectată folosind formule electronice. De exemplu, pentru un atom de magneziu, distribuția electronilor de-a lungul nivelurilor de energie va fi după cum urmează: 2e, 8e, 2e. Această formulă arată că cei 12 electroni ai unui atom de magneziu sunt distribuiți pe trei niveluri de energie: primul nivel este complet și conține 2 electroni, al doilea nivel este complet și conține 8 electroni, al treilea nivel este incomplet deoarece contine 2 electroni. Pentru un atom de calciu, distribuția electronilor de-a lungul nivelurilor de energie va fi după cum urmează: 2e, 8e, 8e, 2e. Această formulă arată că 20 de electroni de calciu sunt distribuiți pe patru niveluri de energie: primul nivel este complet și conține 2 electroni, al doilea nivel este complet și conține 8 electroni, al treilea nivel este incomplet deoarece conține 8 electroni, al patrulea nivel nu este finalizat, deoarece contine 2 electroni.