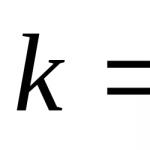Masa molară a lui nh4oh. Hidroxid de amoniu: compoziție și masă molară
Echivalent poate fi numită o particulă reală sau condiționată a unei substanțe care poate înlocui, adăuga sau poate fi într-un alt mod echivalent cu un ion de hidrogen în reacțiile acido-bazice sau de schimb ionic sau cu un electron în reacțiile redox.
Echivalentul masei molare în majoritatea reacțiilor de schimb (care au loc fără modificarea stărilor de oxidare ale elementelor implicate) poate fi calculat ca raport dintre masa molară a substanței și numărul de legături rupte sau formate per un atom sau o moleculă în timpul unei reacție chimică.
Echivalentul de masă molară al aceleiași substanțe poate fi diferit în diferite reacții.
Echivalentul de masă molară în reacțiile redox (care apar odată cu modificarea stărilor de oxidare a elementelor implicate în acestea) poate fi calculat ca raport dintre masa molară a unei substanțe și numărul de electroni dați sau acceptați pe atom sau moleculă în timpul o reacție chimică.
Pentru a găsi masa echivalentă a unei substanțe în soluție, utilizați relații simple:
Pentru acid H n A m:
E k =M/n, Unde n – numărul de ioni Н+în acid. De exemplu, masa echivalentă a acidului clorhidric HCl este: E k=M/1, adică egal numeric cu masa molară; masa echivalentă a acidului fosforic H 3 PO 4 este egală cu: E k=M/3, adică de 3 ori mai mică decât masa sa molară.
Pentru baza Kn(OH)m:
E principal =M/m, Unde m – numărul de hidroxid-one OH -în formula de bază. De exemplu, masa echivalentă a hidroxidului de amoniu NH 4 OH este egală cu masa sa molară: E principal=M/1; masa echivalentă a hidroxidului de cupru (II) Cu(OH) 2 este de 2 ori mai mică decât masa sa molară: E principal=M/2.
Pentru sare K n A m:
E s =M/(n×m), Unde n și m, respectiv, numărul de cationi și anioni de sare. De exemplu, masa echivalentă a sulfatului de aluminiu Al 2 (SO 4 ) 3 este: E s=M/(2×3)=M/6.
Legea echivalenților - pentru fiecare echivalent al unei substanțe într-o reacție există 1 echivalent al unei alte substanțe.
Din legea echivalentelor rezultă că Masele (sau volumele) substanțelor care reacţionează și cele rezultate sunt proporționale cu masele molare (volumele molare) ale echivalentelor lor.. Pentru oricare două substanțe legate prin legea echivalentelor, putem scrie:
Unde m 1 și m 2 – mase de reactivi si (sau) produse de reactie, g;
E 1, E 2– mase molare de echivalenți de reactivi și (sau) produși de reacție, g/mol;
V 1 , V 2 – volume de reactivi și (sau) produse de reacție, l;
EV 1, EV 2– volume molare de echivalenți de reactivi și (sau) produși de reacție, l/mol.
Substantele gazoase, pe langa masa molara a echivalentului, au echivalent de volum molar (EV -volumul ocupat de echivalentul de masă molară sau volumul unui echivalent molar). La nr. EV(O2) = 5,6 l/mol EV(H2) = 11,2 l/mol ,
Sarcina 1. Arderea unei mase de 12,4 g dintr-un element necunoscut a consumat un volum de 6,72 litri de oxigen. Calculați echivalentul elementului și determinați care element a fost luat în reacția dată.
Conform legii echivalentelor
EV(O 2) – volum echivalent de oxigen egal cu 5,6 l
E(element) = 10,3 g/mol-echiv
Pentru a determina un element, trebuie să-i găsiți masa molară. Valența unui element (V), masa molară (M) și echivalentul (E) sunt legate prin relația E = , deci M = E∙V, (unde B este valența elementului).
În această problemă, valența unui element nu este indicată, prin urmare, la rezolvare este necesar să se folosească metoda de selecție, ținând cont de regulile de determinare a valenței - un element situat în impar (I, III, V, VII) grupul tabelului periodic poate avea o valență egală cu orice număr impar, dar nu mai mult decât numărul grupului; un element situat într-o grupă pară (II, IV, VI, VIII) a tabelului periodic poate avea o valență egală cu orice număr par, dar nu mai mare decât numărul grupului.
M = E ∙ V = 10,3 ∙ I = 10,3 g/mol
M = E ∙ V = 10,3 ∙ II = 20,6 g/mol
Nu există niciun element cu masa atomică 10,3 în tabelul periodic, așa că continuăm selecția.
M = E ∙ V = 10,3 ∙ III = 30,9 g/mol
Aceasta este masa atomică a elementului numărul 15, acest element este fosfor (P).
(Fosforul este situat în grupa V a tabelului periodic; valența acestui element poate fi egală cu III).
Răspuns: elementul este fosfor (P).
Sarcina 2. S-au folosit 5,6 g de hidroxid de potasiu pentru a dizolva 3,269 g de metal necunoscut. Calculați echivalentul metalului și determinați care metal a fost luat pentru această reacție.
Conform legii echivalentelor:
Echivalentul unei baze este definit ca raportul dintre masa ei molară și numărul de grupe OH - din bază: M(KOH)=Ar(K)+ Ar(O)+ Ar(H) =39+16+1 =56 g/mol
E(KOH) = = 56 g/mol
Echivalent metal E(Me) = = = 32,69 g/mol-echiv
În această problemă, valența elementului nu este indicată, așa că la rezolvare este necesar să se folosească metoda de selecție, ținând cont de regulile de determinare a valenței. Valența este întotdeauna egală cu numere întregi, M = E ∙ V = 32,69 ∙ I = 32,69 g/mol
Nu există niciun element cu masa atomică 10,3 în tabelul periodic, așa că continuăm selecția.
M = E ∙ V = 32,69 ∙ II = 65,38 g/mol.
Aceasta este masa molară a elementului zinc (Zn).
Răspuns: metal - zinc, Zn
Sarcina 3. Metalul formează un oxid în care fracție de masă metalul este de 70%. Determinați ce metal este inclus în oxid.
Să luăm masa oxidului egală cu 100 g, apoi masa metalului va fi egală cu 70 g (adică 70% din 100 g), iar masa oxigenului va fi egală cu:
m(O)= m(oxid)-m(Me) = 100 – 70 =30 g
Să folosim legea echivalentelor:
, unde E(O) = 8 g.
E(Me) = = 18,67 g/mol-echiv
M (Me) = E ∙ V = 18,69 ∙ I = 18,69 g/mol
M = E ∙ V = 18,69 ∙ II = 37,34 g/mol.Nu există niciun element cu o astfel de masă molară în tabelul periodic, așa că continuăm selecția.
M = E ∙ V = 18,69 ∙ III = 56 g/mol.
Aceasta este masa molară a elementului Fier (Fe).
Răspuns: metal - Fier (Fe).
Sarcina 4. Acidul dibazic conține 2,04% hidrogen, 32,65% sulf și 65,31% oxigen. Determinați valența sulfului din acest acid.
Să luăm masa acidului egală cu 100 g, apoi masa hidrogenului va fi egală cu 2,04 g (adică 2,04% din 100 g), masa sulfului este de 32,65 g, masa oxigenului este de 65,31 g.
Găsim echivalentul sulfului cu oxigen folosind legea echivalentelor:
, unde E(O) = 8 g.
E (S) = = = 4 g/mol-echiv
Valența sulfului dacă toți atomii de oxigen sunt atașați de sulf va fi egală cu:
B = = = 8, prin urmare, atomii de oxigen formează opt în acest acid legături chimice. Prin definiție, un acid este dibazic, ceea ce înseamnă că două legături formate din atomi de oxigen sunt asociate cu doi atomi de hidrogen. Astfel, din opt legături de oxigen, șase legături sunt folosite per compus cu sulf, adică. Valența sulfului în acest acid este VI. Un atom de oxigen formează două legături (valențe), astfel încât numărul de atomi de oxigen dintr-un acid poate fi calculat după cum urmează:
n(O) = = 4.
În consecință, formula acidă va fi H2S04.
Valența sulfului în acid este VI, formula acidului este H 2 SO 4 (acid sulfuric).
Convertor de lungime și distanță Convertor de masă Convertor de volum în vrac și alimente Convertor de zonă Convertor de volum și unități în retete culinare Convertor de temperatură Presiune, efort mecanic, Convertor de modul Young Convertor de energie și de lucru Convertor de putere Convertor de forță Convertor de timp Convertor de viteză liniar Unghi plat Convertor de eficiență termică și eficiență a combustibilului Convertor de număr în diferite sisteme numerice Convertor de unități de măsură ale cantității de informații Rate de schimb Dimensiuni îmbrăcăminte pentru femeiși încălțăminte Mărimi îmbrăcăminte și încălțăminte pentru bărbați Convertor de viteză unghiulară și viteză de rotație Convertor de accelerație Convertor de accelerație unghiulară Convertor de densitate Convertor de volum specific Convertor de moment de inerție Convertor de cuplu Convertor de cuplu Convertor de căldură specifică de ardere (în masă) Convertor de densitate de energie și căldură specifică de ardere de combustibil (în masă) Convertor de diferență de temperatură Convertor de coeficient de dilatare termică Convertor de rezistență termică Convertor de conductivitate termică Convertor de capacitate termică specifică Convertor de putere de expunere la energie și radiații termice Convertor de densitate a fluxului de căldură Convertor de coeficient de transfer de căldură Convertor de debit volumic Convertor de debit de masă Convertor de debit molar Convertor de densitate a fluxului de masă Convertor de concentrație molară Convertor de masă Concentrație în soluție Convertor de vâscozitate dinamică (absolută) Convertor de viscozitate cinematic Convertor de tensiune superficială Convertor de permeabilitate la vapori Convertor de densitate de flux de vapori de apă Convertor de nivel sonor Convertor de sensibilitate microfon Convertor de nivel de presiune sonoră (SPL) Convertor de nivel de presiune sonoră cu presiune de referință selectabilă Convertor de luminozitate Convertor de intensitate luminoasă Convertor Iluminare Grafică computerizată Convertor de rezoluție Convertor de frecvență și lungime de undă Putere dioptrică și lungime focală Putere dioptrică și mărire a lentilei (×) Convertor de încărcare electrică Convertor de densitate de încărcare liniară Convertor de densitate de încărcare de suprafață Convertor de densitate de încărcare de volum Convertor curent electric Convertor liniar de densitate de curent Convertor de densitate de curent de suprafață Convertor de tensiune câmp electric Convertor electrostatic de potențial și tensiune rezistenta electrica Convertor de rezistivitate electrică Convertor conductivitate electrică Convertor de conductivitate electrică Capacitate electrică Convertor de inductanță Convertor de gabarit american de sârmă Niveluri în dBm (dBm sau dBm), dBV (dBV), wați și alte unități Convertor de forță magnetomotor Convertor de tensiune câmp magnetic Convertor de flux magnetic Convertor de inducție magnetică Radiație. Convertor de viteză de doză absorbită de radiații ionizante Radioactivitate. Convertor de dezintegrare radioactivă Radiație. Convertor de doză de expunere Radiație. Convertor de doză absorbită Convertor de prefix zecimal Transfer de date Convertor de tipografie și unități de imagistică Convertor de unitate de volum pentru lemn Calcul masei molare Tabel periodic elemente chimice D. I. Mendeleev
Formula chimică
Masa molară a NH 4 OH, hidroxid de amoniu 35.0458 g/mol
14.0067+1.00794 4+15.9994+1.00794
Fracțiile de masă ale elementelor din compus
Folosind Calculatorul de masă molară
- Formulele chimice trebuie introduse cu distincție între majuscule și minuscule
- Indicele sunt introduse ca numere obișnuite
- Punct pe linia mediană(semnul de multiplicare), folosit, de exemplu, în formulele hidraților cristalini, este înlocuit cu un punct obișnuit.
- Exemplu: în loc de CuSO₄·5H₂O în convertor, pentru ușurința introducerii, se folosește ortografia CuSO4.5H2O.
Calculator de masă molară
Mol
Toate substanțele sunt formate din atomi și molecule. În chimie, este important să se măsoare cu precizie masa substanțelor care reacționează și sunt produse ca rezultat. Prin definiție, molul este unitatea SI de cantitate a unei substanțe. Un mol conține exact 6,02214076×10²³ particule elementare. Această valoare este egală numeric cu constanta lui Avogadro N A când este exprimată în unități de mol⁻¹ și se numește numărul lui Avogadro. Cantitatea de substanță (simbol n) a unui sistem este o măsură a numărului de elemente structurale. Element structural poate fi un atom, moleculă, ion, electron sau orice particulă sau grup de particule.
Constanta lui Avogadro N A = 6,02214076×10²³ mol⁻¹. Numărul lui Avogadro este 6,02214076×10²³.
Cu alte cuvinte, un mol este o cantitate de substanță egală ca masă cu suma maselor atomice ale atomilor și moleculelor substanței, înmulțită cu numărul lui Avogadro. Unitatea de măsură a unei substanțe, mol, este una dintre cele șapte unități SI de bază și este simbolizată de mol. Din moment ce numele unității și a acesteia simbol coincid, trebuie remarcat faptul că simbolul nu este refuzat, spre deosebire de numele unității, care poate fi refuzat conform regulilor obișnuite ale limbii ruse. Un mol de carbon-12 pur este egal cu exact 12 g.
Masa molara
masa molara - proprietate fizică a unei substanțe, definită ca raportul dintre masa acelei substanțe și cantitatea de substanță în moli. Cu alte cuvinte, aceasta este masa unui mol dintr-o substanță. Unitatea SI a masei molare este kilogram/mol (kg/mol). Cu toate acestea, chimiștii sunt obișnuiți să folosească unitatea mai convenabilă g/mol.
masa molara = g/mol

Masa molară a elementelor și compușilor
Compușii sunt substanțe formate din atomi diferiți, care sunt înrudite chimic între ele. De exemplu, următoarele substanțe, care pot fi găsite în bucătăria oricărei gospodine, sunt compuși chimici:
- sare (clorură de sodiu) NaCl
- zahăr (zaharoză) C₁₂H₂₂O₁₁
- oțet (soluție de acid acetic) CH₃COOH
Masa molară a unui element chimic în grame pe mol este numeric aceeași cu masa atomilor elementului exprimată în unități de masă atomică (sau daltoni). Masa molară a compușilor este egală cu suma maselor molare ale elementelor care alcătuiesc compusul, ținând cont de numărul de atomi din compus. De exemplu, masa molară a apei (H₂O) este de aproximativ 1 × 2 + 16 = 18 g/mol.
Greutate moleculară

Masa moleculară (denumirea veche este greutatea moleculară) este masa unei molecule, calculată ca suma maselor fiecărui atom care alcătuiește molecula, înmulțită cu numărul de atomi din această moleculă. Greutatea moleculară este fără dimensiuni o mărime fizică egală numeric cu masa molară. Adică, masa moleculară diferă de masa molară ca dimensiune. Deși masa moleculară este adimensională, aceasta are totuși o valoare numită unitatea de masă atomică (amu) sau dalton (Da), care este aproximativ egală cu masa unui proton sau neutron. Unitatea de masă atomică este, de asemenea, numeric egală cu 1 g/mol.
Calculul masei molare
Masa molară se calculează după cum urmează:
- determina masele atomice ale elementelor conform tabelului periodic;
- determinați numărul de atomi ai fiecărui element din formula compusă;
- determina masa molara prin adaugarea maselor atomice ale elementelor incluse in compus inmultit cu numarul acestora.
De exemplu, să calculăm masa molară a acidului acetic
Se compune din:
- doi atomi de carbon
- patru atomi de hidrogen
- doi atomi de oxigen
- carbon C = 2 × 12,0107 g/mol = 24,0214 g/mol
- hidrogen H = 4 × 1,00794 g/mol = 4,03176 g/mol
- oxigen O = 2 × 15,9994 g/mol = 31,9988 g/mol
- masa molara = 24,0214 + 4,03176 + 31,9988 = 60,05196 g/mol
Calculatorul nostru efectuează exact acest calcul. Puteți introduce formula acidului acetic în ea și puteți verifica ce se întâmplă.
Vi se pare dificil să traduceți unitățile de măsură dintr-o limbă în alta? Colegii sunt gata să vă ajute. Postați o întrebare în TCTermsși în câteva minute vei primi un răspuns.
Un gaz incolor cu miros înțepător, amoniacul NH 3 nu numai că se dizolvă bine în apă și eliberează căldură. Substanța interacționează activ cu moleculele de H 2 O pentru a forma un alcali slab. Soluția a primit mai multe denumiri, una dintre ele este apa cu amoniac. Compusul are proprietăți uimitoare, care includ metoda de formare, compoziție și
Formarea ionilor de amoniu
Formula apei cu amoniac este NH4OH. Substanța conține cationul NH 4 +, care este format din nemetale - azot și hidrogen. Atomii de N din molecula de amoniac sunt utilizați pentru a forma doar 3 din cei 5 electronii exteriori, iar o pereche rămâne nerevendicată. Într-o moleculă de apă foarte polarizată, protonii de hidrogen H+ sunt legați slab de oxigen, unul dintre ei devine donator al unei perechi de electroni de azot liber (acceptor).
Un ion de amoniu se formează cu o sarcină pozitivă și un tip special de slab legătură covalentă- donator-acceptator. Prin dimensiunea, încărcătura și alte caracteristici, seamănă cu un cation de potasiu și se comportă ca un compus neobișnuit din punct de vedere chimic care reacționează cu acizii și formează săruri care sunt de mare importanță practică. Denumiri care reflectă caracteristicile preparatului și proprietățile substanței:
- hidroxid de amoniu;
- hidrat de amoniac;
- amoniu caustic.
Precauții
Trebuie avut grijă atunci când lucrați cu amoniacul și derivații acestuia. Important de reținut:
- Apa cu amoniac are un miros neplăcut. Gazul eliberat irită suprafața mucoasă a cavității nazale, ochii și provoacă tuse.
- Când este depozitat în sticle sau fiole lejer închise, se eliberează amoniac.
- Poate fi detectat fără instrumente, chiar prin miros cantitate mica gaz în soluție și aer.
- Raportul dintre molecule și cationi dintr-o soluție se modifică la diferite niveluri de pH.
- La o valoare de aproximativ 7, concentrația gazului toxic NH 3 scade, iar cantitatea de cationi NH 4 +, care sunt mai puțin nocivi pentru organismele vii, crește.
Prepararea hidroxidului de amoniu. Proprietăți fizice

Când amoniacul se dizolvă în apă, se formează apă amoniacală. Formula acestei substanțe este NH 4 OH, dar de fapt sunt prezenți ioni în același timp
Moleculele NH 4 + , OH - , NH 3 și H 2 O În reacția chimică de schimb de ioni dintre amoniac și apă se stabilește o stare de echilibru. Procesul poate fi reflectat folosind o diagramă în care săgețile direcționate invers indică reversibilitatea fenomenelor.
În laborator, apa amoniacală se obține prin experimente cu substanțe care conțin azot. Când amoniacul este amestecat cu apă, se obține un lichid limpede, incolor. La presiuni mari, solubilitatea gazului crește. Apa eliberează mai mult amoniac dizolvat în ea pe măsură ce temperatura crește. Pentru nevoi industriale si agricultura in scara industriala o substanta de 25% se obtine prin dizolvarea amoniacului. A doua metodă implică utilizarea unei reacții cu apa.
Proprietățile chimice ale hidroxidului de amoniu
Când două lichide intră în contact - apa cu amoniac și acid clorhidric - acestea devin acoperite de nori de fum alb. Este format din particule de produs de reacție - clorură de amoniu. Cu o substanță volatilă precum acidul clorhidric, reacția are loc direct în aer.

Proprietățile chimice ușor alcaline ale hidratului de amoniac:
- Substanța se disociază reversibil în apă pentru a forma cationi de amoniu și ion hidroxid.
- În prezența ionului NH 4 +, o soluție incoloră de fenolftaleină devine purpurie, ca în alcalii.
- Interacțiunea chimică cu acizii duce la formarea de săruri de amoniu și apă: NH 4 OH + HCl = NH 4 Cl + H 2 O.
- Apa amoniacală intră în reacții de schimb ionic cu sărurile metalice, care corespund formării unui hidroxid insolubil în apă: 2NH 4 OH + CuCl 2 = 2NH 4 Cl + Cu(OH) 2 (precipitat albastru).
Apa amoniacală: aplicare în diverse sectoare ale economiei
O substanță neobișnuită este utilizată pe scară largă în viața de zi cu zi, agricultură, medicina, industrie. Hidratul de amoniac tehnic este utilizat în agricultură, producția de carbon de sodiu, coloranți și alte tipuri de produse. Îngrășământul lichid conține azot într-o formă care este ușor absorbită de plante. Substanța este considerată cea mai ieftină și mai eficientă pentru aplicarea în perioada de pre-semănat pentru toate culturile agricole.

Producția de apă amoniacală necesită de trei ori mai puțini bani decât producția de granulare solidă îngrășăminte cu azot. Rezervoarele din oțel închise ermetic sunt folosite pentru depozitarea și transportul lichidelor. Unele tipuri de vopsele și produse de albire a părului sunt realizate folosind hidroxid de amoniu. Fiecare instituție medicală are preparate cu amoniac - o soluție de amoniac 10%.
Săruri de amoniu: proprietăți și semnificație practică

Substanțele care se obțin prin reacția hidroxidului de amoniu cu acizii sunt utilizate în activități economice. Sărurile se descompun atunci când sunt încălzite, se dizolvă în apă și sunt supuse hidrolizei. Ei intră în reacții chimice cu alcalii și alte substanțe. Cloruri, nitrați, sulfați, fosfați și
Este foarte important să respectați regulile și măsurile de siguranță atunci când lucrați cu substanțe care conțin ion de amoniu. Atunci când sunt depozitate în depozitele întreprinderilor industriale și agricole, în fermele subsidiare, nu ar trebui să existe contactul acestor compuși cu var și alcalii. Dacă sigiliul pachetelor este rupt, va începe reacție chimică cu degajarea de gaze otrăvitoare. Oricine trebuie să lucreze cu apa cu amoniac și sărurile sale trebuie să cunoască elementele de bază ale chimiei. Sub rezerva respectării cerințelor de siguranță, substanțele utilizate nu vor dăuna oamenilor și mediului.